Задачі для самостійної роботи
1. Характерна лінія Силіцію в спектрі випромінювання дорівнює 250,69нм. Визначте частоту випромінювань, хвильове число і енергію фотона.
2. Відстань між двома спектральними лініями Феруму з довжиною хвиль  нм і
нм і 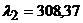 нм дорівнює 10,5мм. Відстань від другої лінії Феруму до лінії елемента, що визначається, становить 2,1мм. Розрахуйте довжину хвилі цього елемента і частоту випромінювання.
нм дорівнює 10,5мм. Відстань від другої лінії Феруму до лінії елемента, що визначається, становить 2,1мм. Розрахуйте довжину хвилі цього елемента і частоту випромінювання.
3. Енергія фотона, що випромінюється, дорівнює 10,2еВ. Визначте частоту випромінювань, довжину хвилі і хвильове число.
4. Частота випромінювань збудженого елемента становить 3,1∙1015Гц. Розрахуйте довжину хвилі, хвильове число і енергію фотона.
5. Хвильове число випромінювання дорівнює 84340см -1. Визначте довжину хвилі, частоту випромінювання і енергію фотона.
6. Потенціал збудження елемента становить 8,5еВ. Обчисліть довжину хвилі, частоту випромінювань і хвильове число.
7. Визначте відстань до спектральної лінії Ніколу з довжиною хвилі 278,07нм від лінії Феруму з  нм, якщо відстань від неї до другої лінії Феруму з
нм, якщо відстань від неї до другої лінії Феруму з  нм дорівнює 3,8мм.
нм дорівнює 3,8мм.
8. Відстань між спектральними лініями Купруму з довжиною хвиль  нм і
нм і 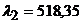 нм дорівнює 10мм. Відстань від першої лінії Купруму до лінії елемента, що визначається, становить 7,5мм. Визначте довжину хвилі елемента і енергію фотона.
нм дорівнює 10мм. Відстань від першої лінії Купруму до лінії елемента, що визначається, становить 7,5мм. Визначте довжину хвилі елемента і енергію фотона.
9. Визначте масову частку Магнію в мідному сплаві за наступними даними спектрального аналізу
| Стандартний зразок | I | II | III | Аналізуємий зразок |
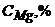
| 0,22 | 0,45 | 0,98 | Х |

| 0,732 | 0,833 | 0,958 | 0,755 |
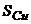
| 0,531 | 0,545 | 0,560 | 0,550 |
10. Відстань між спектральними лініями основного елемента з довжиною хвиль  нм і
нм і  нм становить 8,5мм. Відстань від другої лінії основного елемента до лінії елемента, що визначається, дорівнює 3,5мм. Розрахуйте довжину хвилі визначаємого елемента та частоту випромінювань.
нм становить 8,5мм. Відстань від другої лінії основного елемента до лінії елемента, що визначається, дорівнює 3,5мм. Розрахуйте довжину хвилі визначаємого елемента та частоту випромінювань.
|
|
|
11. Визначте відстань спектральної лінії Купруму з довжиною хвилі 515,32нм від лінії Феруму з довжиною хвилі  нм, якщо відстань від спектральної лінії Купруму до другої лінії Феруму з
нм, якщо відстань від спектральної лінії Купруму до другої лінії Феруму з 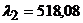 нм складає 4,5мм.
нм складає 4,5мм.
12. Розрахуйте масову частку Купруму в алюмінієвому сплаві за наступними даними спектрального аналізу
| Стандартний зразок | I | II | III | Аналізуємий зразок |

| 0,25 | 0,80 | 1,20 | Х |
| 0,25 | 0,54 | 0,61 | 0,48 |

| 0,50 | 0,51 | 0,55 | 0,52 |
13. Визначте масову частку Ніколу в сталі, якщо при спектральному аналізі отримані наступні дані
| Стандартний зразок | I | II | III | Аналізуємий зразок |

| 1,86 | 3,8 | 10,23 | Х |

| 0,082 | 0,108 | 0,122 | 0,105 |
| 0,062 | 0,066 | 0,047 | 0,067 |
14. Визначте масову частку Молібдену в сталі за наступними даними спектрального аналізу
|
|
|
| Стандартний зразок | I | II | III | Аналізуємий розчин |
| 0,80 | 1,23 | 4,17 | Х |

| 0,562 | 0,564 | 0,590 | 0,570 |
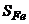
| 0,402 | 0,482 | 0,582 | 0,500 |
15. Оптична густина розчину Германій фенілфлуоронату, який вміщує 5мкг 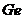 в 50мл розчину, дорівнює 0,450. При цьому була використана кювета товщиною 1см. Обчисліть величину молярного коефіцієнта поглинання.
в 50мл розчину, дорівнює 0,450. При цьому була використана кювета товщиною 1см. Обчисліть величину молярного коефіцієнта поглинання.
16. Наважку сталі масою 0,5000г розчинили і довели об’єм розчину до 50мл. Потім 5мл цього розчину перенесли в колбу на 50мл і, створивши необхідні умови для утворення Нікол диметилгліоксимату, фотометрували забарвлений розчин в кюветі на 1см. Оптична густина розчину становила 0,350. Визначте масову частку Ніколу в сталі, якщо молярний коефіцієнт поглинання дорівнює 4,5∙104л/моль∙см.
17. Розрахуйте масову частку Хрому в сталі за наступними даними спектрального аналізу
| Стандартний зразок | I | II | III | Аналізуємий зразок |

| 0,50 | 1,23 | 4,17 | Х |

| 0,07 | 0,29 | 0,86 | 0,73 |
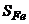
| 0,27 | 0,25 | 0,23 | 0,30 |
18. Визначте найменшу концентрацію розчину Ауруму, якщо мінімальна оптична густина цього розчину, яка вимірювалась в кюветі товщиною 2см, повинна бути не менше 0,05, а молярний коефіцієнт поглинання дорівнює 4,1∙104л/моль∙см.
|
|
|
19. Визначте об’єм розчину, який вміщує 1мкг/мл Ніколу, необхідного для отримання забарвленого розчину з оптичною густиною 0,6, якщо молярний коефіцієнт поглинання забарвленої сполуки дорівнює 3,7∙104л/моль∙см, а товщина кювети 2см.
20. Молярний коефіцієнт поглинання потрійного комплексу Германій – фенілфлуорон – ПАР дорівнює 2,4∙105л/моль∙см. Розрахуйте об’єм розчину, що вміщує 1мкг/мл Германію, який необхідно взяти для отримання розчину з оптичною густиною 0,65. Товщина кювети 1см, колба для розведення 50мл.
21. Визначте масову частку Мангану в сталі, якщо наважку сталі масою 0,5000г розчинили в колбі на 100мл. На фотометрування відібрали 20мл аналізуємого розчину і виконали його за таких же умов, що і стандартні розчини. Оптична густина аналізуємого розчину дорівнювала 0,520. Оптична густина стандартних розчинів становила
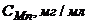
| 1 | 2 | 5 | 8 | 12 |
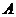
| 0,080 | 0,180 | 0,420 | 0,660 | 0,980 |
22. При визначенні Ауруму в сплаві за методом додатку наважку сплаву масою 0,2000г перевели у розчин, об’єм якого довели до 50мл. У дві мірні колби на 50мл відібрали аліквоти отриманого розчину в 1мл. В одну колбу додали стандартний розчин, що вміщує 0,0005г Ауруму, та усі необхідні реактиви. Потім об’єм цього розчину довели до 50мл. Результати вимірів: Ах=0,3, Ах+ст.=0,45. Обчислить масову частку Ауруму в сплаві.
|
|
|
23. Розрахуйте масову частку Хрому в сталі, якщо наважку сталі масою 0,2500г розчинили в колбі на 100мл. На фотометрування відібрали 25мл цього розчину і проводили його за тих же умов, що і стандартні розчини. Були отримані наступні дані

| 1 | 2 | 4 | 8 | 12 |
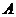
| 0,100 | 0,210 | 0,430 | 0,810 | 1,200 |
Оптична густина аналізуємого розчину дорівнює 0,620.
24. Визначте масову частку Ванадію в сталі, якщо наважку сталі масою 0,3000г розчинили в колбі на 100мл. На фотометрування відібрали 25мл цього розчину і провели його за тих же умов, що і стандартні розчини, для яких отримали наступні дані

| 4 | 8 | 16 | 26 |
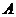
| 0,2 | 0,4 | 0,8 | 1,3 |
Оптична густина аналізуємого розчину дорівнює 0,748.
25. Визначте масову частку Молібдену в сталі, якщо наважку сталі масою 0,5100г розчинили в колбі на 100мл. На фотометрування відібрали 20мл цього розчину. Фотометрували аналізуємий розчин за тих же умов, що і стандартні розчини, для яких отримали наступні результати

| 1 | 2 | 4 | 8 |
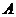
| 0,150 | 0,310 | 0,640 | 1,200 |
Оптична густина розчину, що аналізується, дорівнює 0,680.
26. Визначте масову частку Титану в сталі, якщо наважку сталі масою 1,0000г розчинили в 200мл. На фотометрування відібрали 25мл цього розчину і виконали його за тих же умов, що і стандартні розчини. Були отримані наступні результати

| 1 | 2 | 4 | 8 |
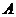
| 0,080 | 0,175 | 0,350 | 0,720 |
Оптична густина аналізуємого розчину дорівнює 0,545.
27. При визначенні Титану в сплаві за методом додатку наважку сплаву масою 0,5020г розчинили і довели об’єм розчину до 100мл. Аліквоту розчину в 20мл відібрали в дві мірні колби. Потім в одну з них додали стандартний розчин, що містить 0,0010г Титану, та необхідні реактиви і довели об’єм розчину до 50мл. Розчин фотометрували і отримали результати: Ах=0,320, Ах+ст.=0,435. Розрахуйте масову частку Титану в сплаві.
28. Наважку сталі масою 1,1000г розчинили і довели об’єм розчину до 100мл. У дві колби на 100мл відібрали аліквоти по 15мл цього розчину. В одну з колб додали стандартний розчин, що вміщує 0,0015г Молібдену, та необхідні реактиви і довели об’єм розчину до 100мл. Після фотометрування обох розчинів отримали результати: Ах=0,220 і Ах+ст.=0,315. Розрахуйте масову частку Молібдену в сталі.
29. При визначенні вмісту Ауруму в сплаві за методом додатку наважку цього сплаву масою 0,1500г перевели в розчин та довели його об’єм до 100мл. В дві мірні колби на 50мл відібрали аліквоти по 2мл отриманого розчину. В одну з колб додали стандартний розчин, що вміщує 0,0003г Ауруму, та необхідні реактиви і довели об’єм розчину до 50мл. При фотометруванні розчинів отримали наступні результати: Ах=0,246, Ах+ст.=0,352. Визначте масову частку Ауруму в сплаві.
30. Наважку зразка масою 0,1500г розчинили і довели об’єм розчину до 100мл. У дві колби на 50мл відібрали аліквоти по 10мл цього розчину. В одну з колб додали стандартний розчин, який вміщує 0,0010г Осмію. Після додавання необхідних розчинів довели об’єм розчину до 50мл і отримали наступні результати фотометрування: Ах=0,240, Ах+ст.=0,365. Визначте масову частку Осмію в зразку.
ЛІТЕРАТУРА
1. Алексеев В.Н. Курс качественного химического полумикроанализа. – М.: Химия, 1973. – 578 с.
2. Алексеев В.Н. Количественный анализ. – М.: Химия, 1972. – 504 с.
3. Дымов А.М. Технический анализ. – М.: Металлургия, 1964. – 335 с.
4. Степин В.В., Курбатов В.И., Федорова Н.Д. Анализ черных металлов и сплавов. – М.: Металлургия, 1980. – 266 с.
5. Степин В.В. Анализ цветных металлов и сплавов. – М.: Металлургия, 1974. – 115 с.
6. Лурье Ю.Ю. Справочник по аналитической химии. – М.: Химия, 1979. – 479 с.
7. Булатов М.И., Калинкин И.П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа. – М.: Химия, 1968. – 382 с.
8. Орешенкова Е.Г. Спектральный анализ. – М.: Высш. школа, 1982. – 375 с.
9. Кустанович И.М. Спектральный анализ. – М.: Высш. школа, 1972. – 352 с.
10. Годовская К.И., Живова Е.И. Сборник задач по техническому анализу. – М.: Высш. школа, 1970. – 216 с.
11. Поляк Н.А., Булацкая Г.Н., Бабаевская Т.Т. Сборник задач по количественному анализу. – Минск: Изд-во БГУ, 1973. – 168 с.
12. Гурецкий И.Я., Кузнецов В.В., Кузнецова Л.Б. и др. Практикум по физико-химическим методам анализа. – М.: Химия, 1987. – 248 с.
13. Пятницкий И.В. Теоретические основы аналитической химии. – К.: Вища школа, 1978. – 272 с.
14. Тулюпа Ф.М., Панченко І.С. Аналітична хімія. Навчальний посібник. – Дніпропетровськ: УДХТУ, 2002. – 657 с.
15. Толстоусов В.Н. Эфрос С.М. Задачник по количественному анализу. – Л.: Химия, 1986. – 160 с.
Дата добавления: 2018-04-05; просмотров: 657; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
