Задачі для самостійної роботи
1. Розрахуйте потенціал мідного електрода, зануреного в 0,001М розчин 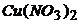 .
. 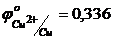 В.
В.
2. Обчисліть потенціал точки еквівалентності в реакції потенціометричного титрування 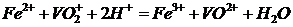 .
. 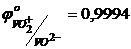 В,
В, 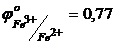 В.
В.
3. Наважку сплаву кольорового металу масою 2,5000г розчинили і об’єм розчину довели до 50мл. Розрахуйте масову частку Плюмбуму в сплаві, якщо висота хвилі на його полярограмі дорівнює 6мм, а на полярограмі стандартного розчину, який вміщує 10-6г/мл Плюмбуму, складає 8мм.
4. Обчисліть час, необхідний для повного виділення Кадмію при електролізі 20мл 0,2н розчину 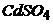 при силі струму 0,1А, якщо вихід Кадмію за струмом складає 93%.
при силі струму 0,1А, якщо вихід Кадмію за струмом складає 93%. 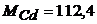 г/моль.
г/моль.
5. При титруванні 5мл розчину 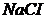 0,15н розчином
0,15н розчином 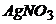 були отримані наступні результати
були отримані наступні результати
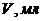
| 10 | 15 | 17 | 19 | 19,5 | 19,9 | 20 | 20,1 | 20,5 | 22 |
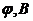
| 0,307 | 0,328 | 0,342 | 0,370 | 0,388 | 0,428 | 0,517 | 0,606 | 0,646 | 0,655 |
Визначте концентрацію 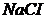 в розчині.
в розчині.
6. Електрорушійна сила гальванічного елемента 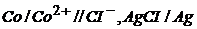 при 25оС дорівнює 0,524В.
при 25оС дорівнює 0,524В. 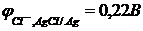 ,
, 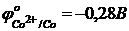 . Розрахуйте концентрацію йонів
. Розрахуйте концентрацію йонів 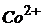 у розчині.
у розчині.
7. Електрорушійна сила гальванічної системи, що складається з насиченого каломельного (електрод порівняння) і срібного (індикаторний) електродів при 25оС дорівнює 0,491В. Визначте концентрацію йонів 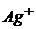 у розчині.
у розчині. 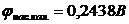 ;
; 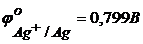 .
.
8. Визначте потенціал срібного електрода в розчині, насиченому відносно 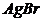 з концентрацією йонів
з концентрацією йонів 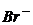 , що дорівнює 1моль/л.
, що дорівнює 1моль/л. 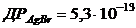 ;
; 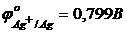 .
.
9. Розрахуйте потенціал платинового електрода в розчині 1М кислоти, що вміщує 0,2М 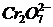 і 0,1М
і 0,1М 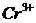 відносно стандартного водневого електрода і насиченого каломельного електрода.
відносно стандартного водневого електрода і насиченого каломельного електрода. 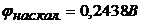 ;
; 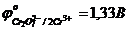 .
.
|
|
|
10. В розчин занурені два електроди: індикаторний – срібний і електрод порівняння – нормальний водневий. Обчисліть електрорушійну силу гальванічного елемента, якщо концентрація йонів 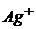 в розчині дорівнює 0,1моль/л.
в розчині дорівнює 0,1моль/л. 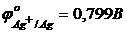 .
.
11. Через розчин Нікол хлориду проходить струм силою 3,5А на протязі 40 хвилин. Обчисліть, скільки грамів твердої речовини і мілілітрів газу виділиться на електродах за нормальних умов? Вкажіть, які речовини виділятимуться на катоді та аноді? Напишіть електродні реакції.
12. При електролізі розчину 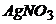 струмом силою 1,5А маса катода збільшилась на 4г. Визначте час перебігу електродної реакції при електролізі.
струмом силою 1,5А маса катода збільшилась на 4г. Визначте час перебігу електродної реакції при електролізі.
13. При проходженні через розчин струму силою 1,5А на протязі 30 хвилин на катоді виділилось 1,071г металу. Обчисліть атомну масу металу та визначте сам елемент.
14. Наважку цинкової руди масою 1,4000г перевели в розчин і повністю виділили з нього Цинк на катоді за 15 хвилин. Сила струму 1,0А. Розрахуйте масу Цинку та його масову частку у вигляді 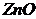 в руді.
в руді.
15. Наважку срібного сплаву масою 2,1550г розчинили і після відповідної обробки довели об’єм розчину до 100мл. При потенціометричному титруванні 25мл цього розчину 0,105М розчином 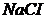 отримали наступні результати
отримали наступні результати
|
|
|
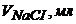
| 16,0 | 18,0 | 19,0 | 19,5 | 19,9 | 20,0 | 20,1 | 20,5 | 21,0 |
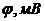
| 689 | 670 | 652 | 634 | 594 | 518 | 440 | 401 | 383 |
Побудуйте криву титрування, знайдіть об’єм Натрій хлориду, витрачений на титрування, обчисліть масову частку Аргентуму в сплаві.
16. Наважку бронзи масою 0,7500г розчинили, об’єм розчину довели до 200мл. Потім провели потенціометричне титрування 20мл розчину, який аналізується, розчином 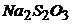 з титром за Купрумом, що дорівнює 0,01664г/мл. Визначте масову частку Купруму в сплаві, якщо при потенціометричному титруванні отримали наступні дані
з титром за Купрумом, що дорівнює 0,01664г/мл. Визначте масову частку Купруму в сплаві, якщо при потенціометричному титруванні отримали наступні дані
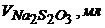
| 1,5 | 1,9 | 2,0 | 2,05 | 2,08 | 2,1 | 2,12 | 2,20 |
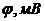
| 475 | 445 | 424 | 405 | 382 | 305 | 186 | 162 |
17. Наважку сталі масою 1,0150г розчинили, після відповідної обробки об’єм розчину довели до 100мл. Потім 20мл розчину, який аналізується, відтитрували 0,0985н розчином солі Мора і отримали наступні дані
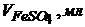
| 3,0 | 4,0 | 4,5 | 5,0 | 6,0 | 7,0 | 8,0 | 9,0 | 9,5 | 10,0 | 10,5 |
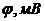
| 930 | 920 | 700 | 520 | 500 | 480 | 460 | 440 | 420 | 360 | 300 |
Побудуйте криву потенціометричного титрування та розрахуйте масову частку Мангану і Ванадію в сталі, знаючи, що перший стрибок потенціалу на кривій титрування відповідає точці кінця титрування Мангану, а другий – сумі Мангану і Ванадію.
|
|
|
18. Наважку манганової руди масою 1,0000г розчинили і після відповідної обробки об’єм розчину довели до 100мл. Потім 25мл розчину, який аналізували, відтитрували розчином солі Мора з титром за Манганом, що дорівнює 0,002564г/мл і отримали наступні дані
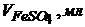
| 7,0 | 8,0 | 9,0 | 10,0 | 10,5 | 11,0 | 11,5 | 12,0 | 13,0 |
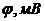
| 950 | 940 | 930 | 920 | 700 | 520 | 500 | 480 | 470 |
Розрахуйте масову частку Мангану в руді.
19. При проведенні полярографічного аналізу розчину, що вміщує йони 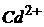 , на фоні амонійно-аміачного розчину з використанням ртутного капаючого електрода отримані наступні дані
, на фоні амонійно-аміачного розчину з використанням ртутного капаючого електрода отримані наступні дані
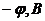
| 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 1,0 |
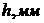
| 2 | 2 | 3 | 3,5 | 4,5 | 25 | 45 | 46 | 47 |
Визначте потенціал півхвилі Кадмію графічним методом.
20. При зніманні полярограми розчину Галію на фоні Трилону Б отримані результати
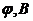
| 0,5 | 0,65 | 0,675 | 0,70 | 0,725 | 0,750 | 0,775 | 0,800 | 0,900 |
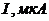
| 0 | 1,1 | 3,6 | 6,9 | 15,0 | 26,8 | 35,8 | 41,0 | 45,0 |
Визначте потенціал півхвилі графічним методом, враховуючи, що граничний дифузійний струм дорівнює 45мкА.
21. Розрахуйте концентрацію йонів 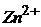 в розчині полярографічним методом, якщо m=2мг/с; D=0,42∙10-5cм2/с; τ=4,4с; I=10мкА.
в розчині полярографічним методом, якщо m=2мг/с; D=0,42∙10-5cм2/с; τ=4,4с; I=10мкА.
22. При визначенні домішку Плюмбуму в металевому Алюмінії наважку сплаву масою 2,5000г розчинили, перенесли в мірну колбу на 50мл і довели об’єм водою до позначки. Висота полярографічної хвилі цього розчину дорівнює 10,0мм. При полярографуванні стандартних розчинів Плюмбуму отримані наступні результати
|
|
|
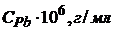
| 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
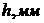
| 4,0 | 8,0 | 12,0 | 16,0 | 20,0 |
Визначте масову частку Плюмбуму в розчині.
23. Наважку сталі масою 0,1000г, що вміщує Купрум, розчинили і довели об’єм розчину до 25мл. Аліквоту цього розчину в 5мл розбавили фоном до 25мл, зняли полярограму і отримали висоту хвилі 37,5мм. Розрахуйте масову частку Купруму в сталі, якщо при полярографуванні 5мл стандартного розчину Купруму з титром 0,000064г/мл, після розведення фоном до 25мл отримали полярограму з висотою хвилі, що дорівнює 30,0мм.
24. Для визначення вмісту Плюмбуму в цинковій руді наважку руди масою 1,000г розчинили і після відповідної обробки об’єм розчину довели до 200мл. Зняли полярограму 20мл цього розчину, отримавши висоту полярографічної хвилі 25мм. Потім в розчин додали 5мл 0,08М розчину Плюмбуму і отримали хвилю висотою у 35мм. Визначте масову частку Плюмбуму в руді.
25. Розрахуйте концентрацію йонів 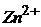 (г/мл) в розчині, що аналізується, якщо при амперометричному титруванні 1мл цього розчину розчином
(г/мл) в розчині, що аналізується, якщо при амперометричному титруванні 1мл цього розчину розчином 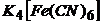 з титром за Цинком 0,00244г/мл отримані наступні дані
з титром за Цинком 0,00244г/мл отримані наступні дані
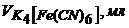
| 0,0 | 0,2 | 0,4 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 |
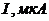
| 30 | 29 | 31 | 32 | 32 | 60 | 137 | 220 | 300 |
26. Визначте концентрацію йонів 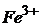 і
і 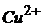 (г/мл) в розчині, який аналізується, якщо при амперометричному титруванні 2мл цього розчину 0,015М розчином меркаптохіноліту отримані наступні дані
(г/мл) в розчині, який аналізується, якщо при амперометричному титруванні 2мл цього розчину 0,015М розчином меркаптохіноліту отримані наступні дані
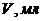
| 0,0 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 | 1,0 | 1,1 | 1,2 |
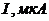
| 15 | 20 | 25 | 30 | 35 | 40 | 50 | 50 | 50 | 55 | 65 | 85 | 100 |
При виконанні аналізу спочатку електрохімічну реакцію з реактивом дають йони 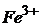 , а потім меркаптохіноліт взаємодіє з йонами
, а потім меркаптохіноліт взаємодіє з йонами 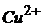 .
.
27. Наважку залізної руди 1,0000г розчинили і після відповідної обробки відтитрували 0,05н розчином 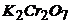 . Обчисліть масову частку Феруму в руді за результатами амперометричного титрування
. Обчисліть масову частку Феруму в руді за результатами амперометричного титрування
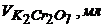
| 0,0 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 | 1,2 | 1,4 |
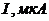
| 100 | 80 | 60 | 40 | 20 | 10 | 10 | 10 |
28. Визначте масову частку Плюмбуму в руді, якщо після розчинення наважки руди масою 1,0000г об’єм розчину довели до 100мл. Після цього 10мл розчину відтитрували 0,05н розчином Натрій сульфату і отримали наступні дані
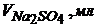
| 0,0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 |
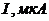
| 215 | 163 | 113 | 60 | 40 | 39 | 38 |
29. При електролізі розчину, який отримали при розчиненні наважки сплаву масою 1,5000г, струмом силою 0,2А на протязі 60 хвилин на катоді виділився Купрум, а на аноді – плюмбум (IV) оксиду. Визначте масову частку Купруму і плюмбум (IV) оксиду в сплаві.
30. При електролізі розчину Кадмій хлориду на аноді виділилось 600мл газу за нормальних умов. Визначте масу Кадмію, що виділилась на катоді.
ОПТИЧНІ МЕТОДИ АНАЛІЗУ
В аналітичному контролі продукції чорної металургії найбільш широко використовують оптичні методи, які базуються на вивченні взаємодії електромагнітних випромінювань з речовиною, що аналізується.
В залежності від природи взаємодії електромагнітних випромінювань з аналізуємими речовинами розрізняють:
1. Абсорбційний спектральний аналіз, що ґрунтується на вивченні поглинання аналізуємою речовиною електромагнітних випромінювань від стороннього джерела. До нього відносяться молекулярний спектральний аналіз (фотометрія) і атомно-абсорбційний спектральний аналіз.
2. Емісійний спектральний аналіз, в основі якого лежить вивчення електромагнітних випромінювань, що випромінюються аналізуємою речовиною під дією високих температур або рентгенівських промінів. До цієї групи методів відносяться атомно-емісійний спектральний аналіз і рентгеноспектральний аналіз. Для цих методів характерні універсальність, висока чутливість, точність і швидкість. Усі методи дозволяють автоматизувати аналіз і являються експресними.
Фотометричний метод аналізу
Фотометричний метод аналізу ґрунтується на вибірковому поглинанні молекулами речовини, що аналізується, електромагнітних випромінювань різних областей спектру.
Метод складається з двох етапів:
1. Проведення хімічної реакції, яка переводить аналізуємий компонент у забарвлену сполуку. Необхідно, щоб забарвлена сполука була міцною і мала постійний склад, а колір її був інтенсивним. Реакції повинні бути чутливими і вибірковими.
2. Вимірювання поглинання світла забарвленим розчином за допомогою приладів або візуально.
Залежність між інтенсивністю забарвлення розчину і вмістом забарвленої сполуки у цьому розчині виражається законом Бугера-Ламберта-Бера 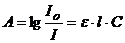 , (7.1)
, (7.1)
де 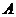 - оптична густина забарвленого розчину;
- оптична густина забарвленого розчину; 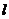 - товщина поглинаючого шару забарвленого розчину, см;
- товщина поглинаючого шару забарвленого розчину, см; 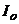 і
і 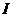 - відповідно інтенсивність світлового потоку, що падає на забарвлений розчин та що пройшов крізь нього;
- відповідно інтенсивність світлового потоку, що падає на забарвлений розчин та що пройшов крізь нього; 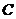 - молярна концентрація розчину, моль/л;
- молярна концентрація розчину, моль/л; 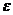 - молярний коефіцієнт поглинання, л/моль∙см. Як видно з рівняння (7.1), молярний коефіцієнт поглинання чисельно дорівнює оптичній густині одномолярного розчину при товщині поглинаючого шару 1см. Молярний коефіцієнт поглинання не залежить від концентрації розчину, товщини поглинаючого шару і інтенсивності освітлення. Чим більше значення має молярний коефіцієнт поглинання, тим чутливішою є реакція.
- молярний коефіцієнт поглинання, л/моль∙см. Як видно з рівняння (7.1), молярний коефіцієнт поглинання чисельно дорівнює оптичній густині одномолярного розчину при товщині поглинаючого шару 1см. Молярний коефіцієнт поглинання не залежить від концентрації розчину, товщини поглинаючого шару і інтенсивності освітлення. Чим більше значення має молярний коефіцієнт поглинання, тим чутливішою є реакція.
Вміст речовини у розчині за результатами фотометричного аналізу можна розрахувати різними методами.
У відповідності до закону Бугера-Ламберта-Бера графік у координатах оптична густина – концентрація має бути лінійним і проходити через початок координат. Градуйований графік звичайно будують мінімум за трьома стандартними розчинами різної концентрації. Спочатку готують забарвлені розчини, потім їх фотометрують і будують графік 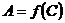 . Далі вимірюють оптичну густину аналізуємого розчину і за допомогою градуйованого графіка визначають концентрацію цього розчину. Метод універсальний і точний, але потребує більшого часу на виконання.
. Далі вимірюють оптичну густину аналізуємого розчину і за допомогою градуйованого графіка визначають концентрацію цього розчину. Метод універсальний і точний, але потребує більшого часу на виконання.
Використовуючи метод стандартів, концентрацію аналізуємого розчину розраховують за формулою
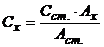 , (7.2)
, (7.2)
де 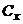 і
і 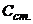 - відповідно концентрації аналізуємого і стандартного розчинів, моль/л;
- відповідно концентрації аналізуємого і стандартного розчинів, моль/л; 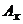 і
і 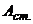 - відповідно оптична густина аналізуємого і стандартного розчинів.
- відповідно оптична густина аналізуємого і стандартного розчинів.
Метод простий, швидкий, але менш точний.
За методом додатку готують два розчини, один – з аліквоти речовини, що визначається, другий – з аліквоти речовини, що визначається, та з додатком стандартного розчину відомої концентрації. Обидва розчини фотометрують за однакових умов. Концентрацію аналізуємого розчину знаходять за рівнянням
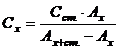 , (7.3)
, (7.3)
де 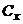 і
і 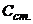 - відповідно концентрації аналізуємого розчину і розчину з додатком стандартного розчину, моль/л;
- відповідно концентрації аналізуємого розчину і розчину з додатком стандартного розчину, моль/л; 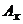 і
і 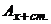 - відповідно оптична густина аналізуємого розчину і розчину з додатком стандартного розчину.
- відповідно оптична густина аналізуємого розчину і розчину з додатком стандартного розчину.
Дата добавления: 2018-04-05; просмотров: 374; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
