ЕЛЕКТРОХІМІЧНІ МЕТОДИ АНАЛІЗУ
Електрохімічні методи аналізу відносяться до групи фізико-хімічних методів аналізу. У порівнянні з класичними хімічними методами аналізу вони мають ряд переваг.
1. Більш велика чутливість, можливе визначення речовин у розчинах з концентрацією до 10-8моль/л.
2. Більш велика вибірковість, що іноді наближається до селективності.
3. Відсутність суб’єктивної помилки експериментатору.
4. Можливість титрування забарвлених і каламутних розчинів.
5. Можливість послідовного титрування з одного розчину декількох елементів, якщо їх потенціали відрізняються один від одного на 0,2-0,3В.
6. Достатньо велика швидкість виконання аналізу.
7. Можливість автоматизації аналізу.
В залежності від фізичних властивостей, які використовують в аналізі, електрохімічні методи поділяють на декілька груп.
1. Методи, засновані на перебігу електродних реакцій у відсутності електричного струму (I=0) – потенціометрія.
2. Методи, засновані на перебігу електродних реакцій під дією струму (I≠0) – полярографія, амперметрія, електрогравіметрія, кулонометрія.
3. Методи, в яких електродні реакції не протікають – кондуктометрія.
В усіх цих методах концентрацію розчину, який аналізують, або масу речовини визначають прямим або побічним (непрямим) методом.
В прямому методі вимірюють аналітичний (фізичний) сигнал і розраховують кількість речовини – потенціометрія, кулонометрія, полярографія.
|
|
|
В побічному методі розчин з речовиною, що визначають, титрують реагентом точно відомої концентрації, будують криву титрування, по якій визначають кінцеву точку титрування, і розраховують вміст компонента, що визначають.
Потенціометричний метод аналізу
В основі потенціометричного методу аналізу лежить залежність окисно-відновного потенціалу від активності (концентрації) реагуючих речовин. Ця залежність виражається рівнянням Нернста
 . (6.1)
. (6.1)
Розрізняють два потенціометричних методи: пряма потенціометрія і потенціометричне титрування.
Пряма потенціометрія ґрунтується на вимірюванні електродного потенціалу з послідуючим розрахунком концентрації речовини, що визначається, за допомогою рівняння Нернста.
В основі потенціометричного титрування лежить вимірювання потенціалу окисно-відновної пари в розчині, який аналізується, в процесі титрування з метою знаходження точки кінця титрування. Точку кінця титрування знаходять за допомогою кривої титрування, побудованої у координатах φ-V. Потім визначають об’єм титрованого розчину і розраховують масову частку або масу компоненту, що визначається.
|
|
|
При потенціометричному титруванні можна обійтись і без побудови кривих титрування, зафіксувавши точку кінця титрування по різкому відхиленню стрілки гальванометра. Вимірюють об’єм реактиву, який було витрачено на реакцію з речовиною, що визначається, і розраховують вміст компоненту в розчині.
В потенціометрії використовують два типи електродів: індикаторний та електрод порівняння.
Індикаторний електрод – це електрод, який швидко і точно реагує на зміну концентрації речовини у процесі титрування.
Електрод порівняння – це електрод, потенціал якого залишається сталим у процесі титрування.
Електрогравіметричний метод аналізу
В електрогравіметрії аналізуємий розчин підлягає електролізу і по збільшенню маси електродів визначають кількість речовини, що визначається. В основі електрогравіметричного методу аналізу лежить закон Фарадея
 , (6.2)
, (6.2)
де  - маса речовини, що виділяється на електроді в процесі електролізу, г;
- маса речовини, що виділяється на електроді в процесі електролізу, г;  - молекулярна маса речовини, що виділяється на електроді, г/моль;
- молекулярна маса речовини, що виділяється на електроді, г/моль;  - кількість електрики, Кл;
- кількість електрики, Кл; 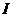 - сила струму, А;
- сила струму, А; 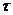 - час електролізу, с;
- час електролізу, с; 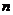 - число електронів, що приймають участь в електрохімічній реакції;
- число електронів, що приймають участь в електрохімічній реакції;  - число Фарадея.
- число Фарадея.
|
|
|
Електрохімічний еквівалент визначається за рівняння
 . (6.3)
. (6.3)
Він показує кількість речовини, яка виділяється на електроді за умови проходження через розчин 1 кулона електрики.
Напруга розкладу речовини при електролізі визначається за рівнянням
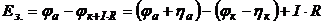 , (6.4)
, (6.4)
де  - електрорушійна сила зовнішнього джерела струму, В;
- електрорушійна сила зовнішнього джерела струму, В;  і
і  - відповідно потенціал анода і катода при електролізі, В;
- відповідно потенціал анода і катода при електролізі, В;  і
і 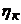 - відповідно анодна і катодна поляризація електродів, В;
- відповідно анодна і катодна поляризація електродів, В;  - сила струму електролізу, А;
- сила струму електролізу, А; 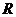 - опір електролізу, Ом.
- опір електролізу, Ом.
Дата добавления: 2018-04-05; просмотров: 622; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
