Задачі для самостійної роботи
1. Визначте розчинність ферум (ІІІ) гідроксиду і концентрацію йонів Fe3+ (г/л) в насиченому розчині.  .
.
2. Визначте добуток розчинності Кальцій карбонату, якщо його розчинність дорівнює 0,00069г/л при 25оС.
3. Розчинність Кальцій карбонату при 250С дорівнює 0,00069г/л. Визначте, у скільки разів зменшиться розчинність Кальцій карбонату, якщо до 0,5л цього розчину додати 10,6г  ?
? 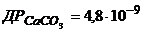 .
.
4. Визначте, чи буде випадати осад Плюмбум (ІІ) хлориду при змішуванні 0,05н розчину Плюмбум (ІІ) нітрату з рівним об’ємом 0,05н розчину гідроген хлориду?  .
.
5. Обчисліть, чи буде утворюватись осад Стронцій сульфату при змішуванні рівних об’ємів 0,001М розчинів  і
і  ?
?  .
.
6. Визначте, чи буде випадати осад Барій сульфату при змішуванні рівних об’ємів 0,001М розчинів 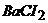 і
і  ?
?  .
.
7. Концентрація йонів 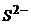 у водному розчині дигідроген сульфіду дорівнює 1,2∙10-13 моль/л. Визначте, чи буде випадати осад Плюмбум сульфіду в насиченому розчині Плюмбум (ІІ) хлориду?
у водному розчині дигідроген сульфіду дорівнює 1,2∙10-13 моль/л. Визначте, чи буде випадати осад Плюмбум сульфіду в насиченому розчині Плюмбум (ІІ) хлориду?  ;
;  .
.
8. Розрахуйте, чи буде випадати осад Плюмбум сульфату, якщо змішати рівні об’єми 10-4М розчину  і 10-3М розчину
і 10-3М розчину  ?
? 
9. Обчисліть величини рН, при яких починається і закінчується осадження алюміній (ІІІ) гідроксиду, якщо  , а початкова концентрація йонів
, а початкова концентрація йонів  в розчині – 0,1 моль/л.
в розчині – 0,1 моль/л.
10. Визначте кількість грамів йонів 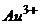 в насиченому розчині
в насиченому розчині  .
.  .
.
11. Розрахуйте кількість грамів йонів  в насиченому розчині Кальцій ортоарсенату.
в насиченому розчині Кальцій ортоарсенату. 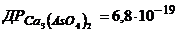 .
.
12. Визначте кількість грамів йонів  в насиченому розчині берлінської блакиті.
в насиченому розчині берлінської блакиті. 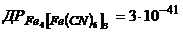 .
.
|
|
|
13. Обчисліть величини рН, при яких починається і закінчується осадження Кадмій сульфіду з 0,01М розчину Кадмій сульфату при насиченні водного розчину дигідроген сульфідом з концентрацією 0,1М.  .
.  .
.
14. Розрахуйте величини рН, при яких починається і закінчується осадження Манган сульфіду з 0,001М розчину Манган (ІІ) хлориду при насиченні водного розчину дигідроген сульфідом з концентрацією 0,1М.  .
.  .
.
15. Визначте величини рН, при яких починається і закінчується осадження ферум (ІІ) гідроксиду і ферум (ІІІ) гідроксиду з 0,1М розчинів відповідних солей. Поясніть різницю в кислотності розчинів. 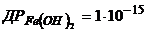 ;
;  .
.
16. Обчисліть величину рН, при який починається осадження хром (ІІ) гідроксиду і хром (ІІІ) гідроксиду з 0,1М розчинів відповідних солей. Поясніть, якому ступеню окислення хрому надають перевагу при його відділенні шляхом осадження розчином аміаку? 
 .
.
17. Розрахуйте добуток розчинності Барій пірофосфату, якщо в 100мл розчину міститься 88,47∙10-4г  .
.
18. Визначте, чи випаде осад  , якщо змішати рівні об’єми 0,01М розчинів
, якщо змішати рівні об’єми 0,01М розчинів  ,
,  і
і  .
.  ;
;  ;
;  .
.
19. Розчин містить 0,16г бром-іону. Визначте кількість мілілітрів 10-2М розчину Плюмбум (ІІ) нітрату, який потрібен для осадження  .
.  .
.
|
|
|
20. Визначте, чи буде досягнуте повне осадження Кобальт сульфіду, якщо пропускати дигідроген сульфіду до насичення через 0,01М розчин Кобальт (ІІ) хлориду при рН=7?  ;
;  ;
;  .
.
21. Чи можна вважати розчин Аргентум ортофосфату насиченим, якщо концентрація йонів  в цьому розчині дорівнює 9,6∙10-6 моль/л?
в цьому розчині дорівнює 9,6∙10-6 моль/л?  .
.
22. Розрахуйте, чи буде утворюватись осад магній (ІІ) гідроксиду з 0,02М розчину Магній (ІІ) хлориду у присутності 0,02М розчину Амоній хлориду?  .
.
23. Визначте концентрацію хромат-іонів на початку осадження Плюмбум хромату з 0,01М розчину Плюмбум (ІІ) нітрату.  .
.
24. Чи можливе осадження Цинк сульфіду з розчину, що містить 0,04моль/л Цинк сульфату і 0,4моль/л Амоній хлориду, насиченого дигідроген сульфідом? 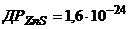 ;
;  ;
;  .
.
25. Визначте концентрацію амоній гідроксиду, при якій починається утворення осаду ферум (ІІІ) гідроксиду з 0,001М розчину Ферум (ІІІ) хлориду.  ;
;  .
.
26. Визначте концентрацію йонів  : а) в насиченому розчині Плюмбум хромату; б) в насиченому розчині Плюмбум хромату в присутності 0,01М розчину
: а) в насиченому розчині Плюмбум хромату; б) в насиченому розчині Плюмбум хромату в присутності 0,01М розчину 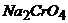 ; в) в насиченому розчині Плюмбум хромату в присутності 0,01М розчину
; в) в насиченому розчині Плюмбум хромату в присутності 0,01М розчину  .
.  .
.
27. Розрахуйте, чи буде утворюватись осад Манган сульфіду при насиченні гідроген сульфідом розчину, що містить 0,01М  , 0,1М
, 0,1М  і 0,01М
і 0,01М  ?
? 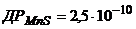 ;
;  ;
;  ;
;  .
.
|
|
|
28. Визначте рН розчину, при якому з 0,01М Ферум (ІІ) сульфату не буде випадати осад Ферум (ІІ) сульфіду при насиченні цього розчину дигідроген сульфідом.  ;
;  ;
;  .
.
29. Визначте добуток розчинності Плюмбум (ІІ) йодиду, якщо для розчинення 1,16г цієї солі потрібно 2л води.
30. Визначте залишковий вміст йонів  (г/л) при насиченні розчину гідроген сульфідом при рН=1.
(г/л) при насиченні розчину гідроген сульфідом при рН=1.  ;
;  ;
;  .
.
4. РЕАКЦІЇ КОМПЛЕКСОУТВОРЮВАННЯ І ОКИСНЕННЯ-ВІДНОВЛЕННЯ В ХІМІЧНОМУ АНАЛІЗІ
Комплексні сполуки широко використовують як в якісному, так і в кількісному аналізі речовин. Найчастіше їх застосовують у гравіметричному, титриметричному, спектрофотометричному аналізі, при маскуванні сторонніх йонів та розчиненні осадів.
В молекулі комплексної сполуки центральне положення займає позитивно заряджений йон, який називається комплексоутворювачем. З ним зв’язані йони або молекули, які називають лігандами. Разом з центральним йоном ліганди утворюють внутрішню сферу комплексної сполуки, яку при написанні беруть у квадратні дужки. Йони, що розміщуються за внутрішньою сферою утворюють зовнішню сферу комплексної сполуки.
У водних розчинах комплексні сполуки дисоціюють за типом сильного електроліту на прості та комплексні йони. В свою чергу комплексні йони у водному розчині дисоціюють як слабкі електроліти.
|
|
|
 .
.
Міцність комплексних йонів характеризується константами нестійкості комплексу.
 , (4.1)
, (4.1)
де  - рівноважна концентрація йонів комплексоутворювача;
- рівноважна концентрація йонів комплексоутворювача;
 - рівноважна концентрація йонів ліганду в ступені, що дорівнює координаційному числу – m;
- рівноважна концентрація йонів ліганду в ступені, що дорівнює координаційному числу – m; 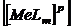 - рівноважна концентрація комплексного йона в розчині; р – заряд комплексного йона.
- рівноважна концентрація комплексного йона в розчині; р – заряд комплексного йона.
Комплексний йон тим стійкіший, чим менша його константа нестійкості. Величини констант нестійкості залежать від природи комплексу і температури.
Реакції окиснення – відновлення також мають велике значення у хімічному аналізі. До них відносяться реакції, в яких відбувається перехід електронів від йонів або атомів одних речовин до інших.
Кількісною характеристикою реакцій окиснення – відновлення є окисно–відновний потенціал. На електродний потенціал окисно – відновної системи впливають активності (концентрації) окисної і відновної форми, температура і, в багатьох випадках, рН середовища. Залежність електродного потенціалу (φ) від цих факторів виражає рівняння Нернста
 (4.2)
(4.2)
де φо – стандартний окисно – відновний потенціал даної системи, В; F – стала Фарадея ( 96484 Кл/моль ); R – універсальна газова стала ( 8,31 Дж/моль∙К ); n – кількість електронів, що беруть участь в електродному процесі; 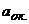 і
і  - активності окисної і відновної форм системи. Т – абсолютна температура, К;
- активності окисної і відновної форм системи. Т – абсолютна температура, К;
Якщо в рівнянні Нернста замість буквених позначень внести їх числові значення, взяти температуру 298К, замінити натуральний логарифм десятковим, то одержимо рівняння Нернста, зручне для розрахунків потенціалу окисно – відновної системи
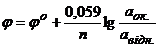 . (4.3)
. (4.3)
Для розбавлених розчинів активність окисної та відновної форм можна замінити їх рівноважними концентраціями. Тоді рівняння Нернста матиме вигляд
 . (4.4)
. (4.4)
Для металевих редокс – систем  розрахункова формула виглядає наступним чином
розрахункова формула виглядає наступним чином
 або
або  . (4.5)
. (4.5)
У випадках, коли оксигенвміщуюча окисна форма переходить у відновну за участю йонів гідрогену, треба при розрахунках потенціалу враховувати рН середовища
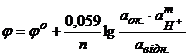 або
або  , (4.6)
, (4.6)
де 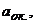


 - відповідно активності і концентрації окисної та відновної форм системи;
- відповідно активності і концентрації окисної та відновної форм системи; 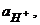
 - відповідно активність і концентрація йонів гідрогену в розчині, m – число йонів гідрогену, що приймають участь у реакції.
- відповідно активність і концентрація йонів гідрогену в розчині, m – число йонів гідрогену, що приймають участь у реакції.
Потенціал водневого електрода визначається за рівнянням
 або
або  , (4.7)
, (4.7)
де  ,
,  - відповідно активність і концентрація йонів гідрогену в розчині;
- відповідно активність і концентрація йонів гідрогену в розчині; 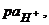
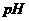 - відповідно показник активності йонів гідрогену і водневий показник.
- відповідно показник активності йонів гідрогену і водневий показник.
Електрорушійну силу гальванічного елемента можна обчислити за формулою
 , (4.8)
, (4.8)
де  і
і  - відповідно потенціал катода і анода, В.
- відповідно потенціал катода і анода, В.
Електрорушійну силу концентраційного елемента, що складається з двох однакових електродів, занурених у розчини одного і того самого електроліту різної концентрації, можна визначити за рівнянням
 , (4.9)
, (4.9)
де  і
і  - активності йонів металу в розчинах за умови, що
- активності йонів металу в розчинах за умови, що  >
>  .
.
Константу рівноваги окисно – відновної реакції розраховують за рівнянням
 , (4.10)
, (4.10)
де  ,
,  - стандартні потенціали окисника і відновника, В; n – кількість електронів, що приймає участь в окисно – відновній реакції.
- стандартні потенціали окисника і відновника, В; n – кількість електронів, що приймає участь в окисно – відновній реакції.
Розв’язування типових задач
Задача 1.Визначте, як зміниться концентрація йонів  в 0,1М розчині
в 0,1М розчині  , якщо до нього додати 1М розчин аміаку.
, якщо до нього додати 1М розчин аміаку. 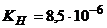 .
.
Розв’язування. Дисоціація комплексної сполуки  відбувається за схемою
відбувається за схемою
 ,
,
 .
.
Константа нестійкості комплексного йону має вигляд
 .
.
Якщо прийняти, що дисоціює  комплексних йонів
комплексних йонів  , то при цьому утворюється
, то при цьому утворюється  йонів
йонів  і 4
і 4 
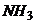 . Оскільки ступінь дисоціації комплексу мала, то можна вважати, що
. Оскільки ступінь дисоціації комплексу мала, то можна вважати, що 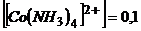 моль/л.
моль/л.
Тоді 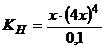 .
.
Звідси
 моль/л.
моль/л.
Якщо до розчину комплексної сполуки додати 1М розчин  , то
, то
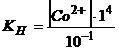 , а
, а  моль/л.
моль/л.
Після додавання до розчину комплексної сполуки 1М розчину  , дисоціація комплексного йону знизилась. Концентрація йонів
, дисоціація комплексного йону знизилась. Концентрація йонів  зменшилась у
зменшилась у  разів.
разів.
Задача 2. Визначте константу рівноваги і напрямок реакції 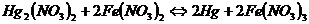 .
.
Розв’язування. В реакції приймають участь дві електрохімічні системи:

 ,
,

 .
.
Константу рівноваги окисно – відновної реакції розрахуємо за рівнянням (4.10)
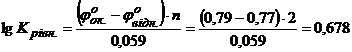 .
.
Звідси  .
.
Оскільки константа рівноваги незначно відрізняється від одиниці, то система знаходиться близько до рівноважного стану, злегка зсунутому в бік продуктів реакції.
Задача 3. Визначте, чи буде утворюватись осад Аргентум йодиду, якщо до 0,1М розчину  додати 16,6г
додати 16,6г 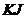 ?
?  ;
;  .
.
Розв’язування. Комплексна сполука дисоціює за схемою
 ,
,
 .
.
Константа нестійкості комплексного йону має вигляд
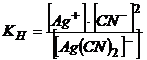 .
.
Якщо дисоціює  комплексних йонів
комплексних йонів  , то утворюється
, то утворюється  йонів
йонів  + і 2
+ і 2  йонів
йонів  . Оскільки ступінь дисоціації комплексу мала, то можна вважати, що концентрація йонів
. Оскільки ступінь дисоціації комплексу мала, то можна вважати, що концентрація йонів 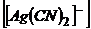 =0,1моль/л. Тоді
=0,1моль/л. Тоді
 .
.
Звідси
 моль/л.
моль/л.
Розрахуємо кількість молей доданої солі 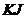
 .
.
Оскільки 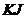 - сильний електроліт, то
- сильний електроліт, то  моль. Осад
моль. Осад  буде випадати, якщо
буде випадати, якщо 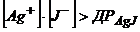 .
.
 .
.
Так як знайдена величина більша за добуток розчинності  , то осад утворюється.
, то осад утворюється.
Задача 4. Визначте потенціал окисно-відновної пари 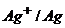 в насиченому розчині Аргентум йодиду , а також після додавання в розчин 3,32г/л Калій йодиду. Поясніть причини зміни потенціалу.
в насиченому розчині Аргентум йодиду , а також після додавання в розчин 3,32г/л Калій йодиду. Поясніть причини зміни потенціалу.  ;
;  .
.
Розв’язування. Потенціал срібного електрода зануреного у насичений розчин Аргентум йодиду розрахуємо за рівнянням Нернста (4.5)
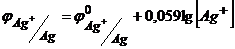 .
.
Концентрацію йонів  у розчині розрахуємо, виходячи з добутку розчинності
у розчині розрахуємо, виходячи з добутку розчинності  .
.
 .
.
 , оскільки
, оскільки 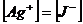 , то
, то
 моль/л.
моль/л.
Тоді
 В.
В.
Після додавання у розчин солі 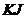 концентрація йонів
концентрація йонів  буде дорівнювати концентрації розчиненої солі з однойменним аніоном, що становитиме
буде дорівнювати концентрації розчиненої солі з однойменним аніоном, що становитиме
 моль.
моль.
З добутку розчинності  знайдемо концентрацію йонів
знайдемо концентрацію йонів 
 моль/л.
моль/л.
Тоді
 В.
В.
Потенціал електрода різко зменшується, переходячи в негативну область, за рахунок зменшення ступеня дисоціації малорозчинної сполуки завдяки додаванню солі з однойменним йоном.
Дата добавления: 2018-04-05; просмотров: 862; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
