Задачі для самостійної роботи
1. Визначте рН розчину, одержаного при розчиненні 1,12л HCI в 500мл води за нормальних умов.
2. Визначте рН розчину, одержаного при розчиненні 4г натрій гідроксиду в 10л води.
3. Розрахуйте рН розчину, отриманого при розведенні 50мл 40,2%-го розчину етанової кислоти водою до 1000мл. ρ=1,05г/мл. КД,Нас=1,74∙10-5.
4. Обчисліть рН розчину, одержаного при розчиненні 2,24л HCI в 6000мл води за нормальних умов.
5. Розрахуйте рОН розчину, одержаного при розведенні 100мл 10%-го розчину метанової кислоти водою до 1500мл. КД,НСООН=1,8∙10-4. ρ=1,05г/мл.
6. Визначте концентрацію йонів гідрогену і гідроксиду в розчині, 250мл якого містить 10,6г Na2CO3. 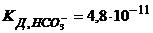 .
.
7. Розрахуйте концентрацію йонів гідрогену, йонів гідроксиду і ступінь гідролізу солі в розчині, 500мл якого містить 8,2г NaАс. КД,НАс=1,74∙10-5.
8. Визначте концентрацію йонів гідроксиду і ступінь гідролізу солі в розчині, 200мл якого містить 1,06г NaНCO3.  .
. 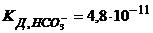 .
.
9. Визначте концентрацію йонів гідрогену в розчинах: а) 0,5М розчин NaН2РO4; б) 0,3М розчин Na2НРO4. рК1=1,96; рК2=6,76; рК3=12,44.
10. Розрахуйте концентрацію йонів гідроксиду і ступінь гідролізу солі Амоній хлориду, отриманого при розчиненні 2,675г NH4CI в 500мл води.  .
.
11. Визначте концентрацію йонів гідрогену і гідроксиду в розчині NH4Ас, отриманого при розчиненні 3,85г солі в 250мл води. КД,НАс=1,74∙10-5.  .
.
12. Визначте концентрацію йонів гідрогену і водневий показник розчину, одержаного при розчиненні 6г NаАс і 12г етанової кислоти в 1л води. КД,НАс=1,74∙10-5.
13. В 250мл води розчинили 50мл 40%-го розчину амоній гідроксиду густиною 0,88г/мл і 17,8г Амоній хлориду. Визначте концентрацію йонів гідроксиду і водневий показник одержаного розчину.  .
.
14. Визначте активність йонів гідрогену в розчині, отриманому при розчиненні 1,12л Гідроген хлориду в 500мл води за нормальних умов.
15. В 500мл води розчинили 150мл 40,2%-го розчину етанової кислоти густиною 1,05г/мл. КД,НАс=1,74∙10-5. Визначте активність йонів гідрогену та ступінь дисоціації кислоти в отриманому розчині.
16. Розрахуйте активність йонів гідрогену в розчині, який отримали шляхом змішування 50мл 40%-го розчину H2SO4 густиною 1,3г/мл і 300мл води.
17. Визначте активність йонів гідрогену в розчині, який отримали шляхом змішування 50мл 40%-го розчину ортофосфатної кислоти густиною 1,46г/мл і 12,5г Натрій ортофосфату з 500мл води, враховуючи тільки першу ступінь дисоціації кислоти.  .
.
18. Розрахуйте, у скільки разів зміниться концентрація йонів гідрогену, якщо в 500мл 0,1М розчину метанової кислоти розчинити 13,6г Натрій форміату?
19. Скільки грамів Натрій ацетату необхідно додати до 400мл 0,1М етанової кислоти, щоб зменшити концентрацію іонів гідрогену в розчині в 100 разів? КД,НАс=1,74∙10-5.
20. Скільки мілілітрів 30%-го розчину амоній гідроксиду густиною 0,892г/мл треба додати до розчину, який вміщує 10,7г Амоній хлориду в 500мл розчину, щоб рН=9,5?  .
.
21. Визначте концентрацію і активність йонів гідрогену, рН розчину, одержаного при розчиненні 6,675г Алюміній хлориду в 500мл розчину. Константа гідролізу солі дорівнює 1,35∙10-5.
22. Скільки грамів Ферум (III) хлориду необхідно розчинити в 500мл розчину, щоб рН=1,9? Константа гідролізу солі дорівнює 3,0∙10-3.
23.Скільки грамів етандіової кислоти треба розчинити в 100мл розчину, щоб рН розчину дорівнював 8,5? 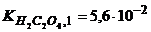 ;
;  .
.
24. Визначте ступінь дисоціації і рН розчину, одержаного при розчиненні 50мл 30%-го розчину амоній гідроксиду густиною 0,892г/мл в 200 мл води.  .
.
25. 500 розчину вміщує 4,3 пропенової кислоти. Визначте концентрацію йонів гідрогену, рН розчину і ступінь дисоціації кислоти в цьому розчині. 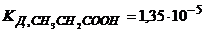 .
.
26. Скільки грамів Амоній хлориду необхідно додати до 200мл 0,1М розчину амоній гідроксиду, щоб зменшити концентрацію йонів гідроксиду в 100 разі?  .
.
27. 500мл розчину вміщує 6,2г ортоборатної кислоти. Як зміниться рН розчину, якщо додати 20,2г Натрій тетраборату?  .
.
28. рН 0,1М розчину калієвої солі слабкої одноосновної кислоти дорівнює 9,07. Визначте константу і ступінь гідролізу цієї солі.
29. До 30мл води додали 5мл 3М розчину  . Розрахуйте концентрацію йонів гідроксиду і рН отриманого розчину.
. Розрахуйте концентрацію йонів гідроксиду і рН отриманого розчину. 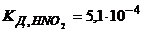 .
.
30. Скільки міліграмів Калій ціаніду міститься в 100мл розчину, рН якого дорівнює 10,46?  .
.
3. РІВНОВАГА В СИСТЕМАХ ОСАД- РОЗЧИН. ДОБУТОК РОЗЧИННОСТІ
В аналітичній практиці дуже широко використовують процеси утворення і розчинення осадів. Розчинність різних речовин в одному і тому ж розчиннику або однієї речовини в різних розчинниках може коливатися у дуже широких межах. Кількісно розчинність визначають вмістом речовини (концентрацією) у насиченому розчині, тобто такому, який характеризується динамічною рівновагою за умови сталої температури:
нерозчинена речовина (осад) ↔ речовина у розчині.
Всі солі, в тому числі і малорозчинні, відносяться до сильних електролітів. Через це при осадженні чи розчиненні малорозчинної солі у водному розчині в рівновазі з осадом знаходяться тільки йони солі. Рівняння динамічної рівноваги має вигляд
 .
.
В стані рівноваги за умови сталої температури за одиницю часу в розчин переходить така кількість сполуки, яка за цей же час з розчину випадає в осад. Ця динамічна гетерогенна рівновага описується правилом добутку розчинності.
В насиченому розчині при сталій температурі добуток активностей йонів малорозчинного електроліту є сталою величиною і називається добутком розчинності (ДР).
 або (3.1)
або (3.1)
 , (3.2)
, (3.2)
де  і
і  - відповідно концентрації катіонів і аніонів;
- відповідно концентрації катіонів і аніонів;
 і
і  - коефіцієнти активностей катіонів і аніонів.
- коефіцієнти активностей катіонів і аніонів.
Оскільки розчинність малорозчинного електроліту у воді дуже мала, то й концентрація йонів у розчині буде малою, а йонна сила розчину буде близькою до нуля. Тому коефіцієнти активностей йонів в таких розчинах будуть дорівнювати одиниці або наближатимуться до неї. Через це у виразах добутків розчинності можна замість добутку активностей брати добуток концентрацій йонів.
 . (3.3)
. (3.3)
Це значно спрощує розрахунки розчинності малорозчинних сполук.
Вираз добутку розчинності малорозчинної сполуки  , що дисоціює за рівнянням
, що дисоціює за рівнянням
 ,
,
матиме вигляд
 . (3.4)
. (3.4)
Умови виділення та розчинення осаду електроліту:
- якщо  , то розчин пересичений, осад випадає;
, то розчин пересичений, осад випадає;
- якщо  , то розчин насичений, система знаходиться у стані рівноваги;
, то розчин насичений, система знаходиться у стані рівноваги;
- якщо  , то розчин ненасичений, осад розчиняється.
, то розчин ненасичений, осад розчиняється.
Осадження вважається повним, якщо концентрація йонів в розчині не перевищує 10-6моль/л або 10-4г/л (межа чутливості аналітичних терезів).
Величина добутку розчинності використовується не тільки при вирішенні різних питань, пов’язаних з йонів осадженням у вигляді малорозчинних сполук, але і при визначенні умов переведення малорозчинних осадів у розчин. Важливою характеристикою малорозчинних сполук є їх розчинність в різних розчинниках.
Для бінарної малорозчинної сполуки  розчинність розраховується за рівнянням
розчинність розраховується за рівнянням
 , (3.5)
, (3.5)
для малорозчинних сполук типу 
 . (3.6)
. (3.6)
Для розчинення осаду треба зменшити концентрацію хоча б одного з йонів, що входить до складу малорозчинної сполуки. Це можливо внаслідок: утворення слабкого електроліту; утворення стійких комплексних йонів; зв’язування йонів у летку сполуку; зміни ступеня окиснення.
Розв’язування типових задач
Задача 1. Визначте кількість грамів йонів  в 1л насиченого розчину Барій ортофосфату. Розрахуйте, як зміниться концентрація йонів
в 1л насиченого розчину Барій ортофосфату. Розрахуйте, як зміниться концентрація йонів  , якщо в 1л цього розчину розчинити 16,4г Натрій ортофосфату?
, якщо в 1л цього розчину розчинити 16,4г Натрій ортофосфату?  .
.
Розв’язування. Ва3(РО4)2 – це малорозчинна сполука, яка дисоціює за рівнянням  .
.
Оскільки з однієї молекули солі Ва3(РО4)2 утворюються 3 йони  і 2 йони
і 2 йони  , то прийнявши концентрацію солі в розчині за Х, одержимо
, то прийнявши концентрацію солі в розчині за Х, одержимо  і
і  . Тоді
. Тоді
 .
.
Розрахуємо розчинність цієї сполуки за рівнянням (3.6)
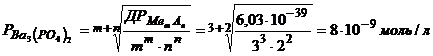 .
.
Концентрація йонів  у розчині дорівнює
у розчині дорівнює
 моль/л,
моль/л,
а в г/л  г/л.
г/л.
При введенні в розчин солі Na3PO4 можна прийняти, що загальна концентрація йонів  в розчині буде дорівнювати концентрації цієї солі. Концентрацією йонів
в розчині буде дорівнювати концентрації цієї солі. Концентрацією йонів  , що утворюються при розчиненні Ва3(РО4)2, можна знехтувати, оскільки розчинність цієї сполуки дуже мала.
, що утворюються при розчиненні Ва3(РО4)2, можна знехтувати, оскільки розчинність цієї сполуки дуже мала.
Визначимо молярну концентрацію солі Na3PO4:
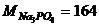 г/моль;
г/моль;  моль/л;
моль/л;  моль/л.
моль/л.
Вираз добутку розчинності Ва3(РО4)2 після додавання у розчин солі Na3PO4 матиме вигляд  .
.
Звідси 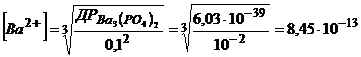 моль/л.
моль/л.
Концентрація йонів  після додавання до 1л розчину 16,4г Na3PO4 зменшилась у
після додавання до 1л розчину 16,4г Na3PO4 зменшилась у
 разів.
разів.
Задача 2. Визначте добуток розчинності Стронцій карбонату, якщо його розчинність при 25оС дорівнює 0,001554г/л.  г/моль.
г/моль.
Розв’язування. Визначимо розчинність  в моль/л
в моль/л
 моль/л.
моль/л.
Стронцій карбонату дисоціює за схемою
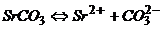 .
.
Виходячи з рівняння дисоціації, одержуємо формулу добутку розчинності
 .
.
Задача 3. Розрахуйте величини рН, при яких починається і закінчується осадження кобальт гідроксиду з 0,1М розчину Кобальт сульфату.  .
.
Розв’язування. У розчині  дисоціює за схемою
дисоціює за схемою
 .
.
Тоді добуток розчинності становитиме
 .
.
Оскільки  - сильний електроліт і при дисоціації однієї молекули солі
- сильний електроліт і при дисоціації однієї молекули солі  утворюється один йон
утворюється один йон  , то
, то  моль/л, а
моль/л, а
 .
.
Звідси
 моль/л.
моль/л.
Виходячи з йонного добутку води, маємо
 моль/л.
моль/л.
Водневий показник розчину на початку осадження  буде дорівнювати
буде дорівнювати
 .
.
В кінці осадження концентрація йонів  повинна дорівнювати 10-6моль/л.
повинна дорівнювати 10-6моль/л.
Тоді  ,
,
 ,
,
а 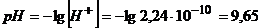 .
.
Задача 4. Визначте, чи випаде осад Нікель сульфіду з 0,1М розчину Нікель сульфату, що містить 0,2М етанової кислоти, при насиченні розчину дигідроген сульфідом при кімнатній температурі?  ;
;  ;
; 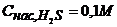 ;
;  .
.
Розв’язування. Дигідроген сульфіду – слабка кислота, яка дисоціює за схемою  .
.
Звідси
 ,
,
а  .
.
Концентрацію йонів гідрогену в розчині слабкої етанової кислоти розрахуємо за рівнянням (2.17)
 моль/л.
моль/л.
Тоді
 моль/л.
моль/л.
Оскільки  - сильний електроліт, то
- сильний електроліт, то  моль/л.
моль/л.
Осадок малорозчинної сполуки буде випадати за умови, якщо  .
.
 .
.
Отже, за цих умов осад  буде випадати.
буде випадати.
Дата добавления: 2018-04-05; просмотров: 556; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
