ТЕОРЕТИЧНІ ОСНОВИ РЕАКЦІЙ КИСЛОТНО-ОСНОВНОЇ ВЗАЄМОДІЇ
Властивості води. Йонний добуток води. Водневий показник
Реакції, що застосовують в аналітичній хімії, найчастіше протікають у водних розчинах. Вода є досить слабким електролітом, в результаті дисоціації якого у розчин надходять йони гідрогену та гідроксиду. Спрощено дисоціацію води без урахування стадії утворення йону гідроксонію  можна записати
можна записати
 .
.
Для стану рівноваги константа дисоціації води має вигляд
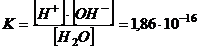 моль/л. (2.1)
моль/л. (2.1)
Оскільки в дисоційованій формі перебуває мізерна частина молекул води, то концентрацію її недисоційованих молекул вважають сталою величиною. Рівняння (2.1) можна записати
 , (2.2)
, (2.2)
де  йонний добуток води.
йонний добуток води.
Як би не змінювались концентрації йонів  або
або  , їх добуток у будь-якому водному розчині є величиною сталою при кімнатній температурі. Йонний добуток води залежить лише від температури. З підвищенням температури збільшується йонний добуток води. При
, їх добуток у будь-якому водному розчині є величиною сталою при кімнатній температурі. Йонний добуток води залежить лише від температури. З підвищенням температури збільшується йонний добуток води. При 
 , а концентрації йонів гідрогену та гідроксиду однакові:
, а концентрації йонів гідрогену та гідроксиду однакові:  моль/л. Співвідношення між концентраціями йонів гідрогену та гідроксиду справедливе не лише для чистої води, але й для будь-яких водних розчинів.
моль/л. Співвідношення між концентраціями йонів гідрогену та гідроксиду справедливе не лише для чистої води, але й для будь-яких водних розчинів.
Від концентрації йонів  та
та  залежить кислотність середовища. Характеризуючи концентрацію йонів гідрогену в розчині, на практиці користуються водневим показником
залежить кислотність середовища. Характеризуючи концентрацію йонів гідрогену в розчині, на практиці користуються водневим показником 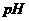
 . (2.3)
. (2.3)
Водневий показник – це від’ємний десятковий логарифм концентрації йонів гідрогену.
За аналогією використовують гідроксидний показник 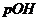
 (2.4)
(2.4)
Величини 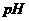 і
і 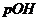 , як і концентрації відповідних йонів, залежать одна від одної. Прологарифмувавши рівняння
, як і концентрації відповідних йонів, залежать одна від одної. Прологарифмувавши рівняння  , дістанемо
, дістанемо
 ;
; 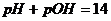 . (2.5)
. (2.5)
Для нейтрального розчину  ,
,  .
.
Для кислого розчину  ,
,  , а
, а  .
.
Для лужного розчину  ,
,  , а
, а  .
.
Електролітична дисоціація. Розчини електролітів
Деякі розчини, що називаються електролітами, взаємодіючи з полярними молекулами розчинника, розпадаються на протилежно заряджені частинки - йони і утворюють розчини, що проводять електричний струм. Розщеплення розчиненої речовини на йони під дією молекул розчинника називають електролітичною дисоціацією. За рахунок йон-дипольної взаємодії молекул розчинника з йонами електроліту утворюються сольватовані (гідратовані) йони.
Процес дисоціації є оборотним. Кількісною характеристикою повноти перебігу електролітичної дисоціації є ступінь дисоціації  - відношення числа молекул, що розпалися на йони
- відношення числа молекул, що розпалися на йони  до загального числа всіх молекул розчиненої речовини
до загального числа всіх молекул розчиненої речовини 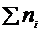
 . (2.6)
. (2.6)
Залежно від ступеня дисоціації електроліти поділяють на сильні і слабкі. Сильні електроліти в розбавлених водних розчинах дисоціюють практично повністю, тобто необоротно. До них відносяться сильні кислоти, луги, а також усі розчинні солі. Слід зазначити, що яким би сильним не був електроліт, значення ступеня дисоціації може тільки наближатися до 100% (або до 1,0), але ніколи цієї межи досягти не може. Слабкі електроліти в розчинах дисоціюють частково, тобто процес їх дисоціації є оборотним. Для слабких електролітів  .
.
Важливою характеристикою процесу дисоціації слабких електролітів є константа дисоціації  . Для бінарного електроліту процес дисоціації можна записати
. Для бінарного електроліту процес дисоціації можна записати
 .
.
Тоді константа дисоціації цього електроліту матиме вигляд
 .
.
Константа дисоціації слабких електролітів пов’язана зі ступенем дисоціації законом розведення Оствальда
 , (2.7)
, (2.7)
де  - молярна концентрація слабкого електроліту, моль/л.
- молярна концентрація слабкого електроліту, моль/л.
Враховуючи, що для слабких електролітів ступінь дисоціації значно менша за одиницю ( 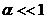 ), то рівняння (2.7) спрощується і закон розведення Оствальда має вигляд
), то рівняння (2.7) спрощується і закон розведення Оствальда має вигляд
 . (2.8)
. (2.8)
При розрахунках замість константи дисоціації дуже часто користуються показником константи дисоціації  , який визначається за рівнянням
, який визначається за рівнянням
 . (2.9)
. (2.9)
Розчини сильних електролітів навіть при дуже великому розведенні не відносяться до ідеальних. Це реальні розчини, де кожний йон взаємодіє з усіма оточуючими його йонами, що викликає відхилення властивостей сильних електролітів від властивостей ідеальних розчинів. Щоб врахувати відхилення властивостей сильних електролітів, ввели поняття активність -  .
.
Активність – це функція концентрації, тиску та температури, підстановка якої в рівняння законів, дійсних для ідеальних систем, дозволяє застосовувати їх для розрахунків властивостей реальних систем. Активність пов’язана з концентрацією розчину через коефіцієнт активності
 , (2.10)
, (2.10)
де 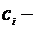 молярна концентрація електроліту, моль/л;
молярна концентрація електроліту, моль/л; 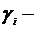 коефіцієнт активності.
коефіцієнт активності.
Для розрахунку коефіцієнту активності в дуже розведених розчинах використовують рівняння першого наближення теорії Дебая - Гюккеля
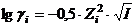 , (2.11)
, (2.11)
де  добуток зарядів катіону і аніону;
добуток зарядів катіону і аніону;  йонна сила розчину, яку розраховують за рівнянням
йонна сила розчину, яку розраховують за рівнянням
 . (2.12)
. (2.12)
Рівняння (2.11) справедливе для розчинів з  .
.
Якщо  , то коефіцієнт активності розраховують за рівнянням другого наближення теорії Дебая – Гюккеля
, то коефіцієнт активності розраховують за рівнянням другого наближення теорії Дебая – Гюккеля
 або
або  . (2.13)
. (2.13)
При виконанні хімічного аналізу різних матеріалів важливу роль відіграє середовище, в якому протікає та чи інша реакція. Оскільки кислотність розчину визначається концентрацією йонів гідрогену, то треба вміти розраховувати концентрацію цих йонів в розчинах сильних і слабких кислот та основ.
Для розчину одноосновної сильної кислоти концентрацію йонів гідрогену та її кислотність розраховують за рівняннями
 ,
,  , (2.14)
, (2.14)
де  молярна концентрація одноосновної сильної кислоти, моль/л.
молярна концентрація одноосновної сильної кислоти, моль/л.
Для концентрованих розчинів розраховують водневий показник, виражений через активність йонів гідрогену
 . (2.15)
. (2.15)
Для сильних однокислотних основ концентрація йонів  визначається за рівняннями
визначається за рівняннями
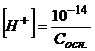 ;
;  , (2.16)
, (2.16)
де  молярна концентрація одноосновної сильної основи, моль/л.
молярна концентрація одноосновної сильної основи, моль/л.
Концентрацію йонів гідрогену в розчинах одноосновної слабкої кислоти розраховують за рівнянням
 , (2.17)
, (2.17)
де  константа дисоціації слабкої кислоти;
константа дисоціації слабкої кислоти;  молярна концентрація слабкої кислоти, моль/л.
молярна концентрація слабкої кислоти, моль/л.
Водневий показник таких кислот визначається за рівнянням
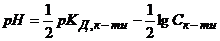 , (2.18)
, (2.18)
де  .
.
Для слабких однокислотних основ
 , (2.19)
, (2.19)
де  константа дисоціації однокислотної слабкої основи;
константа дисоціації однокислотної слабкої основи;  молярна концентрація слабкої основи, моль/л.
молярна концентрація слабкої основи, моль/л.
Водневий показник слабких основ розраховується за рівнянням
 , (2.20)
, (2.20)
де 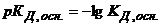 .
.
Дата добавления: 2018-04-05; просмотров: 537; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
