Гідроліз солей в хімічному аналізі
Водні розчини багатьох нейтральних (середніх) солей не є нейтральними, що свідчить про взаємодію їхніх йонів з молекулами води. Причина такої взаємодії криється у можливості утворення під час хімічної реакції слабких електролітів.
Гідроліз – це процес взаємодії розчинених у воді солей з полярними молекулами води.
До гідролізу схильні солі, що утворені слабкою кислотою і сильною основою, сильною кислотою і слабкою основою та слабкою кислотою і слабкою основою.
Кількісно гідроліз характеризують, як і процес дисоціації, двома величинами:
1) ступенем гідролізу  , що показує, яка частина розчиненої солі прогідролізувала у стані рівноваги;
, що показує, яка частина розчиненої солі прогідролізувала у стані рівноваги;
2) константою гідролізу  , як оборотного процесу, в якому через деякий час настає рівновага.
, як оборотного процесу, в якому через деякий час настає рівновага.
Гідроліз солі, утвореної одноосновною слабкою кислотою і сильною основою
Гідроліз таких солей можна представити реакціями в молекулярній та йонно - молекулярній формах
 ,
,
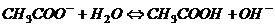 .
.
Константу і ступінь гідролізу солей цього типу розраховують за рівняннями
 . (2.21)
. (2.21)
 . (2.22)
. (2.22)
В результаті гідролізу в розчині накопичуються йони ОН־, змінюючи кислотність середовища. При цьому
 або
або  . (2.23)
. (2.23)
|
|
|
Таким чином, рН розчину зростає зі збільшенням концентрації солі та величини  .
.
Гідроліз солі, утвореної двоосновною слабкою кислотою і сильною основою
Гідроліз солей дво- та багатоосновних кислот ускладнюється тим, що відповідно до ступінчастої дисоціації останніх процес гідролізу також протікає ступінчасто. Наприклад, гідроліз солі  протікає за наступними ступенями:
протікає за наступними ступенями:
перша ступінь  ,
,
 ;
;
друга ступінь 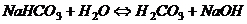 ,
,
 .
.
Солі цього типу гідролізують переважно за першим ступенем, що випливає з порівняння констант дисоціації кислоти за першим та другим ступенем. Гідроліз за другим ступенем майже не здійснюється, оскільки вже на першому ступені утворюється більш слабка кислота  порівняно з тією, яка утворюється за другим ступенем
порівняно з тією, яка утворюється за другим ступенем  .
.

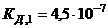 ;
;

 .
.

 . Отже перший ступінь гідролізу є найвигіднішим і завершеним. Схематично гідроліз таких солей можна представити
. Отже перший ступінь гідролізу є найвигіднішим і завершеним. Схематично гідроліз таких солей можна представити
 .
.
Константу гідролізу солей цього типу розраховують за рівнянням
 , (2.24)
, (2.24)
де  - константа дисоціації слабкої кислоти за другим ступенем.
- константа дисоціації слабкої кислоти за другим ступенем.
|
|
|
Ступінь гідролізу визначають за рівнянням
 . (2.25)
. (2.25)
Кислотність розчину такої солі обчислюють за рівняннями
 або
або  . (2.26)
. (2.26)
Гідроліз кислої солі, утвореної слабкою кислотою і сильною основою
Схема гідролізу  .
.
Константу та ступінь гідролізу цих солей розраховують за рівняннями
 ; (2.27)
; (2.27)
 , (2.28)
, (2.28)
де 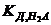 і
і  - відповідно константи дисоціації кислоти за першим та другим ступенем.
- відповідно константи дисоціації кислоти за першим та другим ступенем.
Кислотність розчину солі визначають за рівняннями
 або
або  . (2.29)
. (2.29)
Дата добавления: 2018-04-05; просмотров: 525; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
