Вимоги до реакцій в титриметричному аналізі
Реакції в титриметричному аналізі повинні задовольняти наступним вимогам:
1. Реакції повинні проходити стехіометрично, тобто, проходити згідно з рівнянням реакції.
2. Реакції повинні проходити кількісно, тобто, повнота проходження повинна складати не менше 99,9%.
3. Стандартний (титрований) розчин реактиву повинен реагувати тільки з речовиною, що визначається, тобто, реакція повинна бути специфічною.
4. Реакція між титрованим розчином і розчином речовини, що визначається, повинна проходити з великою швидкістю.
5. Необхідно мати надійний спосіб фіксування точки еквівалентності.
6. В розчині повинні бути відсутніми речовини, що заважають проходженню основної реакції або не дають можливості фіксувати точку еквівалентності.
Класифікація методів титриметричного аналізу
В залежності від типу реакції, що лежить в основі титрування, розрізняють наступні методи аналізу.
1. Метод кислотно – основного титрування
В основі цього методу лежать кислотно – основні реакції, пов’язані із зміною кислотності розчину у процесі титрування. Різка зміна рН спостерігається у точці еквівалентності. Для її фіксації використовують рН-індикатори, які змінюють своє забарвлення в залежності від рН розчину.
2. Метод окисно – відновного титрування
В основі цього методу лежать реакції окиснення – відновлення. В процесі титрування змінюється потенціал розчину. Для визначення точки еквівалентності використовують окисно – відновні (редокс) індикатори, які змінюють своє забарвлення в залежності від потенціалу розчину.
|
|
|
Метод осадження і комплексоутворювання
Титриметричні методи аналізу з використанням реакцій осадження і комплексоутворювання об’єднані в одну групу методів, оскільки багато реакцій осадження за певних умов є і реакціями комплексоутворювання, і навпаки, реакції комплексоутворювання закінчуються утворенням малорозчинних сполук.
Точку еквівалентності в цих методах визначають як індикаторними, так і без індикаторними методами.
За способом титрування розрізняють методи прямого і непрямого титрування.
В методах прямого титрування йон чи компонент, що визначається, титрують титрованим розчином або навпаки.
До методів непрямого титрування належать метод заміщення та метод зворотного титрування (метод залишків).
Метод заміщення полягає в тому, що йони, які визначаються, заміщують еквівалентною кількістю інших йонів, які вже можна визначити прямим титруванням. Цей метод використовують, якщо є труднощі з фіксацією точки еквівалентності.
|
|
|
Метод зворотного титрування (метод залишків) полягає в тому, що до аналізуємого розчину додають точно відомий надлишок титрованого розчину реактиву і титрують цей надлишок відповідним робочим розчином. Метод застосовують в тому випадку, коли немає відповідного індикатора для визначення точки еквівалентності, або, коли реакція проходить надто повільно.
Розрахунки в титриметричному аналізі
1. Розрахунок маси наважки, необхідної для приготування заданого об’єму стандартного розчину відомої концентрації
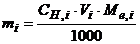 , (5.6)
, (5.6)
де 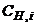 -молярна концентрація еквівалента стандартного розчину, моль-екв/л;
-молярна концентрація еквівалента стандартного розчину, моль-екв/л;  молярна маса еквівалента речовини, г/моль-екв;
молярна маса еквівалента речовини, г/моль-екв;  об’єм розчину, мл.
об’єм розчину, мл.
2. Розрахунки вмісту речовини за методом окремих наважок при прямому титруванні
 ; (5.7)
; (5.7)
 ; (5.8)
; (5.8)
 , (5.9)
, (5.9)
де  об’єм титрованого розчину, мл;
об’єм титрованого розчину, мл;  молярна концентрація еквівалента титрованого розчину, моль-екв/л;
молярна концентрація еквівалента титрованого розчину, моль-екв/л;  молярна маса еквівалента речовини, що визначається, г/моль-екв;
молярна маса еквівалента речовини, що визначається, г/моль-екв; 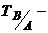 титр титрованого розчину В за речовиною А, г/мл;
титр титрованого розчину В за речовиною А, г/мл;  маса наважки, г.
маса наважки, г.
|
|
|
3. Розрахунок вмісту речовини при титруванні методом аліквотування
 , (5.10)
, (5.10)
де  об’єм титрованого розчину, мл;
об’єм титрованого розчину, мл;  молярна концентрація еквівалента титрованого розчину, моль-екв/л;
молярна концентрація еквівалента титрованого розчину, моль-екв/л;  молярна маса еквівалента речовини, що визначається, г/моль-екв;
молярна маса еквівалента речовини, що визначається, г/моль-екв;  маса наважки, г;
маса наважки, г;  об’єм аліквоти, що брали для титрування, мл;
об’єм аліквоти, що брали для титрування, мл;  об’єм мірної колби, мл.
об’єм мірної колби, мл.
4. Розрахунки вмісту речовини при зворотному титруванні
 , (5.11)
, (5.11)
де  молярна концентрація еквівалента титрованого розчину, надлишок якого додається до аналізуємого розчину, моль-екв/л;
молярна концентрація еквівалента титрованого розчину, надлишок якого додається до аналізуємого розчину, моль-екв/л;  об’єм надлишкового титрованого розчину, мл;
об’єм надлишкового титрованого розчину, мл;  молярна концентрація еквівалента титрованого розчину, яким титрується надлишок, моль-екв/л;
молярна концентрація еквівалента титрованого розчину, яким титрується надлишок, моль-екв/л;  об’єм цього титрованого розчину, мл;
об’єм цього титрованого розчину, мл;  молярна маса еквівалента речовини, що визначається, г/моль-екв;
молярна маса еквівалента речовини, що визначається, г/моль-екв;  маса наважки, г.
маса наважки, г.
5. Розрахунки молярної маси еквівалента
- кислоти  , (5.12)
, (5.12)
де  молярна маса кислоти, г/моль;
молярна маса кислоти, г/моль;  - число йонів Н+, що містить кислота;
- число йонів Н+, що містить кислота;
|
|
|
- основи 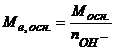 , (5.13)
, (5.13)
де  молярна маса основи, г/моль;
молярна маса основи, г/моль;  - число йонів ОН-, що містить основа;
- число йонів ОН-, що містить основа;
- солі  , (5.14)
, (5.14)
де  молярна маса солі, г/моль;
молярна маса солі, г/моль; 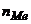 - кількість йонів металу;
- кількість йонів металу;  - заряд йонів металу.
- заряд йонів металу.
Для окисно-відновних реакцій молярна маса еквівалента речовини, що приймає в ній участь, розраховується за рівнянням
 (5.15)
(5.15)
де 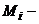 молярна маса речовини, г/моль;
молярна маса речовини, г/моль; 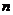 - кількість електронів, що приймає участь в окисно-відновному процесі цієї речовини.
- кількість електронів, що приймає участь в окисно-відновному процесі цієї речовини.
Розв’язування типових задач
Задача 1. Для визначення концентрації розчину хлоридної кислоти узяли наважку 5,206г Натрій карбонату. Наважку розчинили у воді і довели об’єм розчину до 500мл. На титрування 25мл отриманого розчину потрібно 26,2мл розчину кислоти. Розрахуйте молярну концентрацію еквівалента, титр хлоридної кислоти і титр розчину хлоридної кислоти за NaOH.
Розв’язування. При титруванні розчину, що аналізують, розчином хлоридної кислоти протікає реакція
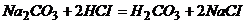 .
.
Молярну концентрацію еквівалента хлоридної кислоти визначимо за рівнянням (5.10)
 .
.
Молярна маса еквівалента Натрій карбонату у відповідності до реакції дорівнює  г/моль-екв.
г/моль-екв.
Тоді  моль-екв/л.
моль-екв/л.
Титр хлоридної кислоти розрахуємо за формулою
 .
.
Молярна маса еквівалента хлоридної кислоти дорівнює
 г/моль-екв.
г/моль-екв.
 г/мл.
г/мл.
Титр розчину хлоридної кислоти за натрій гідроксидом розрахуємо за рівнянням  г/мл,
г/мл,
де 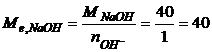 г/моль-екв.
г/моль-екв.
Задача 2. Наважку руди масою 0,5124г розчинили у відповідному розчиннику. На титрування йонів 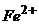 було витрачено 21,3мл 0,1052н розчину
було витрачено 21,3мл 0,1052н розчину 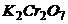 . Визначте масову частку Феруму в розчині.
. Визначте масову частку Феруму в розчині.
Розв’язування. При титруванні аналізуємого розчину 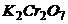 протікає реакція
протікає реакція
 .
.
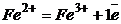 ,
,
 .
.
Масову частку Феруму у руді визначимо за рівнянням (5.9)
 .
.
Молярна маса еквівалента Феруму дорівнює
 г/моль-екв.
г/моль-екв.
Тоді  .
.
Задача 3. Розрахуйте масу наважки 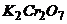 , яку необхідно взяти для приготування 1,5л 0,1021н розчину
, яку необхідно взяти для приготування 1,5л 0,1021н розчину 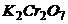 . Розчин призначений для окисно-відновного титрування.
. Розчин призначений для окисно-відновного титрування.
Розв’язування. Масу наважки для приготування розчину заданої концентрації та об’єму розрахуємо за рівнянням (5.6)
 .
.
Оскільки реактив призначений для окисно-відновного титрування, то молярну масу еквівалента 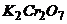 обчислимо, виходячи з рівняння
обчислимо, виходячи з рівняння
 .
.
 г/моль-екв.
г/моль-екв.
Тоді  г.
г.
Задача 4. Наважку руди масою 1,5243г розчинили в мірній колбі об’ємом 500мл. На титрування 10мл розчину було витрачено 17,3мл 0,01н розчину 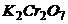 . Визначте масову частку Феруму в руді.
. Визначте масову частку Феруму в руді.
Розв’язування. Вміст Феруму в руді при титруванні розчину методом аліквотування розрахуємо за рівнянням (5.10)
 .
.
Молярна маса еквівалента Феруму дорівнює
 г/моль-екв.
г/моль-екв.
Тоді  .
.
Задача 5. Для визначення вмісту Кальцію наважку шлаку масою 0,5215г розчинили в 50мл 0,1018н розчину 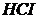 . Після закінчення реакції надлишок
. Після закінчення реакції надлишок 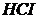 відтитрували 23,7мл 0,1037н розчину
відтитрували 23,7мл 0,1037н розчину 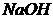 . Розрахуйте масову частку Кальцію в шлаці.
. Розрахуйте масову частку Кальцію в шлаці.
Розв’язування. Для визначення вмісту Кальцію був використаний метод зворотного титрування. В розчині протікають реакції
 ,
,
 .
.
Вміст Кальцію визначимо за рівнянням (5.11)
 .
.
Молярна маса еквівалента Кальцію дорівнює
 г/моль-екв.
г/моль-екв.
Тоді 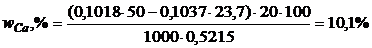 .
.
Дата добавления: 2018-04-05; просмотров: 915; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
