Гідроліз солі, утвореної слабкою основою і сильною кислотою
Гідроліз таких солей можна представити реакціями в молекулярній та йонно - молекулярній формах
 ,
,
 .
.
Схема гідролізу цих солей в загальному вигляді
 .
.
В процесі гідролізу таких солей у розчині накопичуються йони гідрогену. Кислотність розчину розраховують за рівняннями
 або
або  . (2.30)
. (2.30)
Константу та ступінь гідролізу визначають за рівняннями
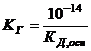 , (2.31)
, (2.31)
 . (2.32)
. (2.32)
Гідроліз солі, утвореної слабкою кислотою і слабкою основою
Гідроліз таких солей можна представити реакцією в молекулярній формі
 .
.
Такі реакції є майже необоротними, оскільки під час їх перебігу утворюються два слабких електроліти.
Схема гідролізу 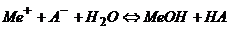 .
.
Константа гідролізу такої солі дорівнює
 . (2.33)
. (2.33)
Ступінь гідролізу розраховують за рівнянням
 . (2.34)
. (2.34)
Водневий показник середовища визначають за рівняннями
 або
або 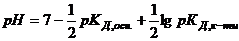 . (2.35)
. (2.35)
Буферні розчини
Буферні розчини – це суміші концентрованих розчинів слабкої кислоти або основи та її солі, що утворена сильною основою або кислотою. Наприклад, суміші оцтової кислоти та ацетату натрію (кислий буферний розчин), суміш гідроксиду та хлориду амонію (лужний буферний розчин).
|
|
|
Значення цих розчинів у хімічному аналізі дуже велике, так як з їх допомогою можна виконувати аналіз матеріалів за контрольованих кислотних умов.
При введенні до буферної суміші розчину сильної кислоти або сильної основи змінюється концентрація слабкої кислоти або основи, проте рН буферного розчину практично не змінюється. Це пояснюється тим, що слабка кислота або слабка основа взагалі мало дисоціює, а при наявності однойменних йонів її солі дисоціація буде ще менш відчутною. Розведення розчину не впливає на його рН, оскільки водневий показник залежить лише від співвідношення концентрацій солі (  ) та кислоти (
) та кислоти ( 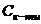 ) і не залежить від ступеня розведення.
) і не залежить від ступеня розведення.
Для кислого буферного розчину, утвореного слабкою кислотою та її сіллю, кислотність обчислюють за рівняннями
 або
або  . (2.36)
. (2.36)
Для лужного буферного розчину, утвореного слабкою основою та її сіллю, кислотність розраховують за рівняннями
 або
або  . (2.37)
. (2.37)
Розв’язування типових задач
Задача 1. Визначте 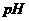 і pαH+ розчину, одержаного при розчиненні 10мл 70%-го розчину сульфатної кислоти густиною 1,61г/мл в 250мл води.
і pαH+ розчину, одержаного при розчиненні 10мл 70%-го розчину сульфатної кислоти густиною 1,61г/мл в 250мл води.
|
|
|
Розв’язування. Маса 10мл розчину H2SO4 дорівнює
 г.
г.
Масу сульфатної кислоти в 10мл 70%-го розчину знайдемо з наступної пропорції
100г розчину вміщує 70г H2SO4,
16,1г розчину вміщує Хг H2SO4,
 г H2SO4.
г H2SO4.
Кількість молей кислоти визначимо за рівнянням
 моль.
моль.
Тоді молярна концентрація розчину H2SO4, враховуючи, що об’єм одержаного розчину Vp=V( H2SO4)+V(H2O)=10+250=260мл, становитиме
 моль/л.
моль/л.
Так як H2SO4 - двоосновна кислота, то концентрація йонів гідрогену в розчині, виходячи з рівняння дисоціації  , буде в два рази більшою за концентрацію кислоти.
, буде в два рази більшою за концентрацію кислоти.
 моль/л.
моль/л.
Звідси водневий показник дорівнюватиме
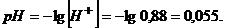
Для визначення водневого показника, вираженого через активність йонів гідрогену, розрахуємо йонну силу розчину за формулою (2.12)
 .
.
Знаючи йонну силу розчину, коефіцієнт активності визначимо за рівнянням (2.13)
 ,
,
 .
.
Тоді активність йонів гідрогену за рівнянням (2.10) дорівнюватиме
 моль/л,
моль/л,
а водневий показник pαH+=-lgαH+=-lg0,475=0,32.
Задача 2. Розрахуйте концентрацію йонів гідрогену і ступінь гідролізу солі в розчині, одержаному при розчиненні 10,6г Натрій гідроген карбонату в 800мл води. Константи дисоціації карбонатної кислоти за ступенями відповідно дорівнюють  ;
; 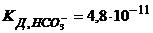 .
.
|
|
|
Розв’язування. Для кислої солі, утвореної слабкою кислотою і сильною основою, концентрацію йонів гідрогену розрахуємо за рівнянням (2.29)
 моль/л.
моль/л.
Для розрахунку ступеня гідролізу треба знайти молярну концентрацію солі. Для чого розрахуємо кількість молей розчиненої солі
 моль,
моль,
де  - молярна маса солі, г/моль.
- молярна маса солі, г/моль.  г/моль.
г/моль.
Тоді молярну концентрацію солі визначимо з відповідної пропорції
800мл розчину вміщує 0,126 моля NaHCO3,
1000мл розчину вміщую Х моль NaHCO3,
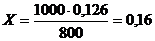 моль/л.
моль/л.
Ступінь гідролізу солі розрахуємо за рівнянням (2.28)
 .
.
Задача 3. Скільки грамів солі NaAc треба додати до 500мл 0,1М розчину етанової кислоти (СН3СООН), щоб зменшити концентрацію йонів гідрогену в розчині у 1000 разів?  .
.
Розв’язування. Розрахуємо концентрацію йонів гідрогену в 0,1М розчині НАс за формулою (2.17)
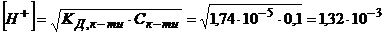 моль/л.
моль/л.
Суміш етанової кислоти з її сіллю – це кислий буферний розчин. Концентрація йонів гідрогену в буферному розчині визначається за рівнянням (2.36)
 .
.
Звідки  .
.
За умовою задачі концентрація йонів гідрогену повинна зменшитися у 1000 разів, тобто 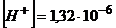 моль/л.
моль/л.
Тоді  моль/л.
моль/л.
Маса солі, яку треба додати до 1л розчину, щоб зменшити концентрацію йонів гідрогену у 1000, дорівнюватиме
|
|
|
 г/л.
г/л.
До 500мл розчину треба додати у два рази менше солі, тобто 54,05г NaAc.
Задача 4. рН 0,2М розчину натрієвої солі слабкої одноосновної кислоти дорівнює 10. Розрахуйте константу і ступінь гідролізу солі.
Розв’язування. Щоб розрахувати константу і ступінь гідролізу солі, утвореної слабкою кислотою і сильною основою, треба визначити константу дисоціації кислоти за рівнянням (2.26)
 і
і 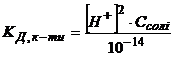 .
.
Оскільки рН=10, то  моль/л.
моль/л.
Тоді 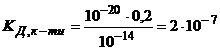 .
.
Константу гідролізу розрахуємо за рівнянням (2.21)
 .
.
Ступінь гідролізу – за рівнянням (2.22)
 .
.
Дата добавления: 2018-04-05; просмотров: 1064; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
