Задачі для самостійної роботи
1. Визначте концентрацію йонів  в розчинах: а)
в розчинах: а) 
 ; б)
; б) 
 ; в)
; в) 
 в присутності
в присутності  розчину
розчину 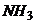 .
.  .
.
2. Константа нестійкості йонів 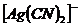 складає
складає  . Визначте концентрацію йонів
. Визначте концентрацію йонів  в
в  розчині
розчині 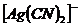 , а також після додавання до цього розчину
, а також після додавання до цього розчину 
 . Пояснить різницю.
. Пояснить різницю.
3. Розрахуйте константу нестійкості йонів  , якщо електрорушійна сила гальванічного елемента
, якщо електрорушійна сила гальванічного елемента 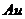 /
/ 
 //
// 
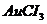 /
/ 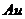 дорівнює
дорівнює  .
.
4. Обчисліть концентрацію іонів 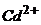 в
в  розчині
розчині 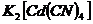 в присутності 6,5г/л
в присутності 6,5г/л  .
. 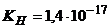 .
.
5. Мідний електрод занурений в  розчини: а)
розчини: а)  ; б)
; б)  ; в)
; в)  . Константи нестійкості цих комплексних сполук відповідно дорівнюють
. Константи нестійкості цих комплексних сполук відповідно дорівнюють  ,
,  ,
, 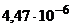 . Визначте потенціал електрода в кожному розчині.
. Визначте потенціал електрода в кожному розчині. 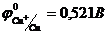 .
.
6. Визначте, чи буде утворюватись осад Аргентум хлориду, якщо до  розчину
розчину  додати 0,1моль хлорид-іону?
додати 0,1моль хлорид-іону?  ,
,  .
.
7. Визначте, чи буде випадати осад 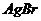 , якщо до
, якщо до  розчину
розчину  , який вміщує 0,1моль/л
, який вміщує 0,1моль/л 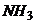 , додати 0,01моль/л
, додати 0,01моль/л  .
.  ;
;  .
.
8. Визначте, чи випаде осад Аргентум броміду, якщо до 0,01М розчину 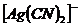 додати 0,1М
додати 0,1М  ?
?  ,
,  .
.
9. Скільки молей аміаку повинен вміщувати 1л 0,1М розчину  , щоб при додаванні до цього розчину
, щоб при додаванні до цього розчину 
 не утворювався осад
не утворювався осад 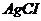 ?
?  ,
,  .
.
10. Розрахуйте масу йонів  , що вміщує 1л 0,1М розчину
, що вміщує 1л 0,1М розчину 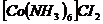 .
.  .
.
11. Розрахуйте константу рівноваги реакції  при
при  і
і  та визначте, в який бік зсунута рівновага цієї реакції.
та визначте, в який бік зсунута рівновага цієї реакції.  ;
;  .
.
12. Розрахуйте потенціал напівреакції 
 при
при  ,
, 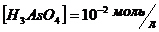 ;
;  .
.  .
.
13. Розрахуйте потенціал напівреакції  при
при  ,
,  ;
;  та визначте окисно-відновну здатність цієї системи.
та визначте окисно-відновну здатність цієї системи.  .
.
14. Напишіть йонно-електронне рівняння окисно-відновної пари  /
/  та розрахуйте потенціал цієї пари при
та розрахуйте потенціал цієї пари при  ,
, 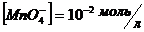 ,
,  . Якими властивостями володіє дана система в окисно-відновних реакціях?
. Якими властивостями володіє дана система в окисно-відновних реакціях?  .
.
|
|
|
15. Складіть йонно-електронне рівняння окисно-відновної пари  /
/  та визначте потенціал цієї пари при
та визначте потенціал цієї пари при  ;
; 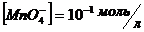 ;
;  .
.
16. Складіть йонно-електронне рівняння окисно-відновної пари  /
/  та визначте потенціал цієї пари при
та визначте потенціал цієї пари при  ,
,  ;
;  .
.
17. Визначте добуток розчинності Аргентум хлориду, якщо електрорушійна сила елемента 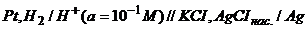 дорівнює
дорівнює  .
.  .
.
18. Розрахуйте добуток розчинності Аргентум хлориду, якщо електрорушійна сила гальванічного елемента 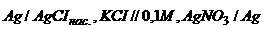 , рівна
, рівна  .
.  ,
,  .
.
19. Електрорушійна сила гальванічного елемента  , дорівнює
, дорівнює  . Визначте активність йонів
. Визначте активність йонів  , якщо концентрація іонів
, якщо концентрація іонів  становить 1моль/л.
становить 1моль/л. 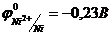 .
.
20. Визначте потенціал окисно-відновної пари  /
/  при
при  ,
,  10-1моль/л,
10-1моль/л,  10-2моль/л,
10-2моль/л, 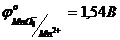 .
.
21. Визначте кислотність середовища, якщо потенціал окисно-відновної пари  /
/  при
при  10-1моль/л;
10-1моль/л;  10-4моль/л, дорівнює
10-4моль/л, дорівнює  .
.  .
.
22. Розрахуйте потенціал срібного електрода, зануреного в насичений розчин  , що вміщує йодид-іони, активність яких дорівнює 1моль/л.
, що вміщує йодид-іони, активність яких дорівнює 1моль/л.  ,
,  .
.
23. Електрорушійна сила гальванічного елемента, що складається з платинового та насиченого каломельного електродів, занурених у розчин з йонами 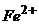 та
та  , дорівнює
, дорівнює  . Знайдіть співвідношення
. Знайдіть співвідношення  .
. 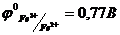 ,
,  .
.
|
|
|
24. Визначте, чи буде випадати осад Аргентум йодиду, якщо до  розчину
розчину  додати 16,6г
додати 16,6г 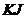 ?
?  ,
,  .
.
25. Розрахуйте електрорушійну силу і константу рівноваги реакції, що протікає в гальванічному елементі  .
. 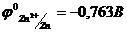 ,
,  . Напишіть рівняння реакції.
. Напишіть рівняння реакції.
26. Розрахуйте константу рівноваги реакцій, в яких уперед необхідно підібрати коефіцієнти:
а) 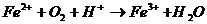 ,
, 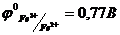 ,
,  ;
;
б)  ,
, 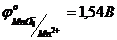 ,
,  .
.
27. Для реакції  розрахуйте константу рівноваги при
розрахуйте константу рівноваги при  і
і 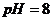 , прийнявши концентрації окисної та відновної форм однаковими. Вкажіть напрям реакції за даних умов.
, прийнявши концентрації окисної та відновної форм однаковими. Вкажіть напрям реакції за даних умов.
 ;
;  .
.
28. Для реакції  розрахуйте константу рівноваги при
розрахуйте константу рівноваги при  і
і  , прийнявши концентрації окисної та відновної форм однаковими. Вкажіть в який бік зсунута рівновага цієї реакції за даних умов?
, прийнявши концентрації окисної та відновної форм однаковими. Вкажіть в який бік зсунута рівновага цієї реакції за даних умов?  ,
,  .
.
29. Розрахуйте потенціал водневого електрода, зануреного: а) в чисту воду; б) в розчин з 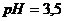 ; в) в розчин з
; в) в розчин з  .
.
30. Розрахуйте потенціал водневого електрода, зануреного: а) в  розчин етанової кислоти,
розчин етанової кислоти,  ; б) в
; б) в  розчин
розчин  ,
,  ; в) в розчин,
; в) в розчин,  якого вміщує
якого вміщує 
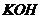 .
.
ХІМІЧНІ МЕТОДИ АНАЛІЗУ
До хімічних методів аналізу відносяться гравіметричний (ваговий), титриметричний (об’ємний) і газооб’ємний методи.
Гравіметричний метод аналізу
Гравіметричним (ваговим) аналізом називають метод кількісного хімічного аналізу, заснований на точному вимірюванні маси речовини, що визначається. Це може бути маса компоненту, який виділяється в елементарному вигляді або у вигляді малорозчинної сполуки, або маса залишку після виділення компоненту, що визначається. За допомогою гравіметричного аналізу визначають масу або концентрацію багатьох речовин, металів, неметалів, складових часток сплавів, руд, природних і промислових об’єктів. Гравіметричний метод аналізу дозволяє визначити вміст речовини з точністю до 0,01-0,005%, але цей метод потребує багато часу і праці.
|
|
|
Гравіметричні методи аналізу діляться на три групи: методи виділення, відгонки і осадження.
У методах виділення компонент, який визначають, виділяють у вільному стані і зважують на аналітичних терезах.
У методах відгонки елемент або компонент, який визначають, переводять за допомогою будь-якого реактиву у летку речовину, потім її відганяють і поглинають. По збільшенню маси поглинача визначають кількість компонента, що визначається. Це прямий метод відгонки.
У непрямих методах відгонки компонент, що визначають, відганяють, а його масу знаходять як різницю між масами речовини до і після відгонки.
|
|
|
У методах осадження наважку речовини, яку аналізують, переводять у розчин, потім елемент, що визначають, осаджують у вигляді малорозчинної сполуки. Осад відокремлюють від розчину фільтруванням, потім його промивають, висушують, прожарюють, охолоджують і зважують. Виходячи з маси осаду, що одержали після прожарювання, обчислюють масу елемента, який визначають, і його масову частку у речовині, що аналізували.
З усіх перерахованих операцій найбільш важливою є операція осадження. Для осадження кристалічних ліофобних і аморфних ліофільних осадів рекомендують брати полуторний надлишок осаджувача і створювати умови, за яких буде досягнуте повне осадження компонента, що визначається. Залишкова концентрація компонента, що визначається, у розчині не повинна перевищувати 10-6моль/л або 10-4г/л - межа чутливості аналітичних терезів. Найкращим осаджувачем є такий, який утворює найменш розчинну сполуку. Бажано, щоб він був леткою речовиною, тоді домішки його в осаді будуть видалятись при прожарюванні. Окрім того осаджувач повинен реагувати тільки з йонами, які осаджують, і не реагувати з іншими, тобто бути специфічним. Специфічність реакції досягають умовами проведення цієї реакції: певною кислотністю та введенням маскуючих речовин, які зв’язують йони, що заважають визначенню.
У гравіметричному аналізі розрізняють осаджувану та гравіметричну форми осаду. Та форма, у вигляді якої переводять компонент, що визначають, в осад, називається осаджуваною, а форма сполуки, яку отримують після прожарювання осаду – гравіметричною.
Осаджувана і гравіметрична форми повинні задовольняти ряду вимог.
Сполука, що є осаджуваною формою, повинна бути малорозчинною, що необхідно для повного осадження елемента, що визначається. Бажано, щоб структура осаду давала можливість з достатньою швидкістю вести фільтрування і відмивання його від домішків. Цій вимозі відповідають крупнокристалічні осади. При прожарюванні форма осадження повинна легко і повністю перетворюватись у гравіметричну форму.
Гравіметрична форма повинна задовольняти наступним вимогам: склад її повинен відповідати певній хімічній формулі, вона повинна бути стійкою до зовнішнього середовища, не реагувати і не адсорбувати вологи та діоксиду вуглецю з повітря. Бажано, щоб частка компоненту, що визначають, у гравіметричній формі була якомога меншою. При цьому помилка визначення буде також меншою.
Важливим параметром гравіметричного аналізу є маса наважки речовини, яку аналізують. Її маса залежить від методу аналізу і характеру осаду. Вона не може бути дуже великою або малою. У першому випадку буде велика кількість осаду, промити його буде дуже важко. Якщо ж наважка занадто мала, то буде велика помилка при зважуванні і при виконанні інших операцій аналізу.
Дослідним шляхом визначили, що раціональною наважкою речовини, що аналізують, буде така, з якої отримують приблизно 0,5г гравіметричної форми, якщо форма осадження є кристалічним ліофобним осадом і 0,1-0,3г гравіметричної форми, якщо форма осадження є аморфним ліофільним осадом. Обчислити масу наважки речовини, що аналізують, можна, користуючись наступними формулами:
- форма осадження є кристалічним осадом
 ; (5.1)
; (5.1)
- форма осадження є аморфним осадом
 , (5.2)
, (5.2)
де 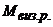 - молярна маса речовини, яку визначають, г/моль;
- молярна маса речовини, яку визначають, г/моль;  - молярна маса гравіметричної форми, г/моль;
- молярна маса гравіметричної форми, г/моль;  і
і 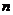 - коефіцієнти, г; 0,5 і 0,1 – раціональні наважки речовини, залежно від характеру осаду форми осадження.
- коефіцієнти, г; 0,5 і 0,1 – раціональні наважки речовини, залежно від характеру осаду форми осадження.
Рівняння для обчислення вмісту речовини, що визначається, мають такий вигляд
 , (5.3)
, (5.3)
 , (5.4)
, (5.4)
де  - маса гравіметричної форми, г;
- маса гравіметричної форми, г;  - маса наважки, г;
- маса наважки, г;  - аналітичний множник (фактор перерахунку).
- аналітичний множник (фактор перерахунку).
Аналітичний множник або фактор перерахунку – це відношення молярної (атомної) маси речовини, що визначають, до молярної маси сполуки, яка є гравіметричною формою. Молярні (атомні) маси речовин беруться з такими коефіцієнтами, щоб вони були еквівалентні одна одній, тобто, щоб вони містили однакову кількість атомів одного елемента.
 (5.5)
(5.5)
де 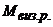 - молярна маса речовини, яку визначають, г/моль;
- молярна маса речовини, яку визначають, г/моль;  - молярна маса гравіметричної форми, г/моль;
- молярна маса гравіметричної форми, г/моль;  і
і 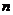 - відповідні коефіцієнти.
- відповідні коефіцієнти.
Розв’язування типових задач.
Задача 1. Розрахуйте фактори перерахунку для визначення: а)  у вигляді
у вигляді  ; б)
; б)  у вигляді
у вигляді  ; в)
; в)  у вигляді
у вигляді 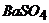 ; г)
; г)  у вигляді
у вигляді  .
.
Розв’язування. Визначимо фактор перерахунку за рівнянням (5.5)
а) 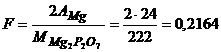 ;
;
б) 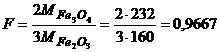 ;
;
в) 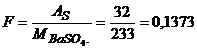 ;
;
г) 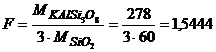 .
.
Задача 2. Визначте вміст хлорид-іонів в зразку, якщо з наважки масою 1,0000г отримали 0,2040г гравіметричної форми 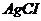 .
.
Розв’язування. Найбільш поширений метод визначення вмісту хлорид-іонів – це їх осадження у вигляді Аргентум хлориду.
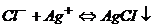 .
.
Переведення осадженої форми у гравіметричну відбувається шляхом висушування осаду
 .
.
Для розрахунку вмісту хлорид-іонів треба розрахувати фактор перерахунку за рівнянням (5.5)
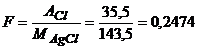 .
.
Масову частку хлорид-іонів визначимо за рівнянням (5.4)
 .
.
Задача 3. Розрахуйте об’єм 0,5М розчину сульфатної кислоти, необхідної для кількісного осадження йонів  з наважки масою 0,5000г, що вміщує
з наважки масою 0,5000г, що вміщує 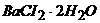 .
.
Розв’язування. При визначенні вмісту йонів  використовують реакцію осадження
використовують реакцію осадження
 .
.
М( 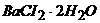 ) = 244г/моль; М(
) = 244г/моль; М(  ) = 98г/моль.
) = 98г/моль.
З рівняння реакції для осадження 1моля солі барію потрібен 1моль сульфатної кислоти. Складемо пропорцію і визначимо масу кислоти
з 244г солі барію вступає у взаємодію 98г  ,
,
з 0,5г солі барію вступає у взаємодію Хг  .
.
 г.
г.
Враховуючи, що для повного осадження йонів  потрібен полуторний надлишок сульфатної кислоти, маса кислоти становитиме
потрібен полуторний надлишок сульфатної кислоти, маса кислоти становитиме
 г.
г.
Об’єм кислоти заданої концентрації, необхідний для повного осадження  , визначимо з рівняння
, визначимо з рівняння
 мл.
мл.
Дата добавления: 2018-04-05; просмотров: 541; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
