Кулонометричний метод аналізу
Кулонометричний метод аналізу ґрунтується на вимірюванні кількості електрики, витраченої на електрохімічне перетворення йонів або елементів, що визначають. Результати аналізу обчислюють за законом Фарадея (6.2). При розрахунках вмісту речовини, яку визначають, дуже часто враховують вихід речовини за струмом ( 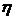 )
)
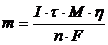 . (6.5)
. (6.5)
Проводячи будь-яке кулонометричне визначення треба створити такі умови електролізу, щоб струм витрачався тільки на потрібну нам електрохімічну реакцію і щоб були виключені побочні процеси, які проходять з витратою електрики. Окрім цього треба точно встановити момент, коли електрохімічна реакція практично повністю закінчиться.
Розрізняють пряму кулонометрію і кулонометричне титрування.
В прямій кулонометрії речовина, яку аналізують, підлягає електрохімічному перетворенню безпосередньо в кулонометричній комірці. Вимірюють за допомогою кулонометрів кількість електрики, витраченої на перебіг електрохімічної реакції, і за законом Фарадея розраховують масу або масову частку речовини.
Кулонометричне титрування ґрунтується на реакції речовини, що визначається, з титрованим розчином, який отримується при електролізі спеціально підібраного розчину безпосередньо в кулонометричній комірці. Через те, що титрований розчин генерується в кількості, яка точно відповідає еквівалентному вмісту речовини, що визначається, то по кількості електрики, витраченої на генерацію титранту можна розраховувати вміст аналізуємої речовини.
|
|
|
Кулонометричне титрування характеризується великою точністю (0,1-0,5%) і чутливістю (10-7%) при концентрації розчинів до 10-6моль/л. Метод не потребує попереднього приготування стандартних (титрованих) розчинів, градуйованих графіків, дозволяє використовувати нестійкі розчини, може бути легко автоматизованим.
Полярографічний метод аналізу
В основі цього методу лежить отримання і вивчення вольт-амперних кривих (полярограм). Вольт-амперні криві отримують при електровідновленні або електроокисненні речовини, що аналізують, на поверхні електрода. Між концентрацією аналізуємої речовини в розчині і граничним дифузійним струмом на ртутному електроді є пропорційна залежність, яка виражається рівнянням Ільковича
 , (6.6)
, (6.6)
де  - граничний дифузійний струм, мкА;
- граничний дифузійний струм, мкА;  - кількість електронів, що приймає участь в електродному процесі;
- кількість електронів, що приймає участь в електродному процесі;  - маса ртуті, що витікає з капіляра за 1с, мг;
- маса ртуті, що витікає з капіляра за 1с, мг; 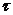 - час витікання краплі ртуті, с;
- час витікання краплі ртуті, с;  - концентрація речовини, що визначається, моль/л.
- концентрація речовини, що визначається, моль/л.
|
|
|
В полярографії використовують лінійну залежність граничного струму від концентрації
 , (6.7)
, (6.7)
де  .
.
Полярографічна хвиля характеризує не тільки кількість аналізуємої речовини, але і її хімічну природу. Граничний дифузійний струм характеризує висоту хвилі (h) і концентрацію речовини, яка аналізується. Потенціал півхвилі (φ1/2) є якісною характеристикою присутніх у розчині йонів. Потенціал півхвилі – це потенціал середини полярографічної хвилі. Він залежить від хімічної природи йонів і є довідниковою величиною.
Для кількісних розрахунків вмісту речовини в аналізуємому розчині використовують декілька методів: розрахунок за рівнянням Ільковича, метод стандартних розчинів, метод градуйованих графіків, метод додатків.
В методі стандартних розчинів користуються формулою
 , (6.8)
, (6.8)
де  і
і  - відповідно концентрації аналізуємого і стандартного розчинів, моль/л;
- відповідно концентрації аналізуємого і стандартного розчинів, моль/л; 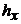 і
і  - відповідно висота полярографічної хвилі аналізуємого і стандартного розчинів, мм.
- відповідно висота полярографічної хвилі аналізуємого і стандартного розчинів, мм.
|
|
|
В методі додатків розраховують вміст речовини за рівнянням
 або
або 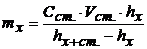 , (6.9)
, (6.9)
де  і
і  - відповідно об’єми аналізуємого і стандартного розчинів, мл;
- відповідно об’єми аналізуємого і стандартного розчинів, мл; 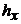 і
і 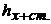 - висота полярографічної хвилі аналізуємого розчину і цього ж розчину з додаванням стандартного розчину, мм.
- висота полярографічної хвилі аналізуємого розчину і цього ж розчину з додаванням стандартного розчину, мм.
Метод градуйованого графіка ґрунтується на визначенні вмісту речовини за допомогою градуйованого графіка, що представляє залежність висоти полярографічної хвилі від концентрації стандартного розчину.
Амперометричне титрування – це різновид полярографічного аналізу. Метод базується на залежності дифузійного струму від концентрації речовини, яка приймає участь в електродному процесі і обумовлює дифузійний струм.
Якщо при полярографічному аналізі необхідно, щоб електродну реакцію давав йон, що визначається, то при амперометричному титруванні це не обов’язково. Достатньо, щоб на електроді окислювався або відновлювався один з учасників реакції, що протікає при титруванні. Точку кінця титрування знаходять по різкій зміні дифузійного струму, який проходить через розчин при постійній напрузі. Титрування припиняють, вимірюють об’єм титрованого розчину, який було витрачено на реакцію з речовиною, що визначається, і розраховують вміст речовини в аналізуємому розчині.
|
|
|
Розв’язування типових задач
Задача 1. Потенціал водневого електрода, зануреного в розчин  , виміряний відносно насиченого каломельного електрода при 298К дорівнює 0,528В. Визначте концентрацію йонів
, виміряний відносно насиченого каломельного електрода при 298К дорівнює 0,528В. Визначте концентрацію йонів  в розчині і рН цього розчину.
в розчині і рН цього розчину.  В.
В.
Розв’язування. Схема гальванічного елемента має вигляд
 .
.
Електрорушійну силу цього елемента можна розрахувати за рівнянням
 ,
,
де 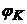 - потенціал катода (каломельний електрод), В;
- потенціал катода (каломельний електрод), В; 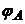 - потенціал анода (водневий електрод), В.
- потенціал анода (водневий електрод), В.
Звідси потенціал водневого електрода дорівнює
 В.
В.
Концентрацію йонів  у розчині можна визначити, виходячи з рівняння Нернста (6.1)
у розчині можна визначити, виходячи з рівняння Нернста (6.1)
 .
.
Потенціал стандартного водневого електрода дорівнює нулю. Тоді
 ,
,
а  моль/л.
моль/л.
Оскільки  , то
, то  .
.
Задача 2. Наважку сплаву, що містить Ферум, масою 1,2000г розчинили, після відповідної обробки довели об’єм розчину до 50мл. 10мл цього розчину відтитрували 0,1н розчином  . Визначте масову частку Феруму в сплаві за результатами потенціометричного титрування
. Визначте масову частку Феруму в сплаві за результатами потенціометричного титрування

| 2,0 | 10,0 | 18,0 | 19,8 | 20,0 | 20,2 | 22,0 | 26,0 |
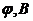
| 0,712 | 0,771 | 0,836 | 0,889 | 1,10 | 1,332 | 1,391 | 1,400 |
Розв’язування. За результатами потенціометричного титрування побудуємо криву титрування, рис. 6.1 і визначимо об’єм титранту, який пішов на титрування розчину, що аналізується.
З графіка видно, що об’єм титрованого розчину, який було витрачено на реакцію з речовиною, що визначається,  дорівнює 20,2мл
дорівнює 20,2мл  .
.
Масову частку Феруму визначимо за рівнянням
 %.
%.

Рис. 6.1. Залежність потенціалу аналізуємого розчину від об’єму
титрованого розчину
Задача 3. Через розчин Кобальт хлориду проходив струм силою 2,5А на протязі 40 хвилин. Вкажіть, які речовини будуть виділятись на катоді та аноді в процесі електролізу? Скільки грамів твердої речовини і мілілітрів газу виділиться на катоді та аноді за нормальних умов?
Розв’язування. Оскільки електролізу піддається електроліт, що дисоціює за схемою
 ,
,
то на катоді відновлюються йони 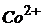 :
:  , а на аноді окислюються йони
, а на аноді окислюються йони  :
:  .
.
Отже, на катоді виділяється металевий Кобальт, а на аноді – газоподібний Хлор.
Розрахунки кількості речовин, що виділились на електродах, виконаємо за допомогою закону Фарадея (6.2)
 г,
г,
 г.
г.
Оскільки 71г  займає об’єм 22,4л за нормальних умов, то 2,21г
займає об’єм 22,4л за нормальних умов, то 2,21г  займе об’єм Хл.
займе об’єм Хл.
 л=697мл.
л=697мл.
Задача 4. Наважку сплаву масою 0,5000г розчинили в 100мл кислоти. 20мл цього розчину після відповідної обробки розбавили до 50мл і зняли полярограму, висота хвилі якої складала 30мм. Потім у цей же розчин додали 1мл стандартного розчину, що має концентрацію йонів 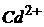 10мг/мл. Висота полярографічної хвилі при цьому склала 55мм. Визначте масову частку Кадмію в сплаві.
10мг/мл. Висота полярографічної хвилі при цьому склала 55мм. Визначте масову частку Кадмію в сплаві.
Розв’язування. Масу Кадмію розрахуємо за рівнянням (6.9)
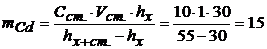 мг=15∙10-3г.
мг=15∙10-3г.
Масова частка Кадмію становитиме
 %.
%.
Задача 5. За результатами полярографічного аналізу розчину, що вміщує йони Галію, побудуйте полярограму та визначте потенціал півхвилі за допомогою полярограми.
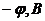
| 0,50 | 0,70 | 0,80 | 0,90 | 1,00 | 1,10 | 1,20 | 1,30 | 1,40 | 1,50 |
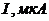
| 20 | 20 | 50 | 80 | 120 | 170 | 190 | 210 | 220 | 220 |
Розв’язування. За експериментальними даними побудуємо полярографічну хвилю.

Рис. 6.2. Залежність сили дифузійного струму від
потенціалу розчину
Потенціал півхвилі – це потенціал середини полярографічної хвилі. Він дорівнює  В.
В.
Задача 6. Наважку іридій-паладієвого сплаву масою 0,1000г розчинили і після відповідної обробки розбавили до 100мл. Потім 5мл цього розчину відтитрували при  В 0,01н розчином тіооксину. Отримали наступні дані
В 0,01н розчином тіооксину. Отримали наступні дані
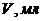
| 0,0 | 0,1 | 0,2 | 0,3 | 0,4 | 0,6 | 0,7 | 0,8 | 0,9 | 1,0 |
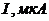
| 5 | 18 | 38 | 52 | 55 | 55 | 55 | 65 | 80 | 100 |
Визначте масову частку Іридію та Паладію в сплаві, враховуючи, що спочатку з реактивом взаємодіє Іридій, а потім Паладій.
Розв’язування. За отриманими даними побудуємо графік залежності 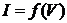 , рис. 6.3.
, рис. 6.3.
За допомогою графіка визначимо об’єм розчину (V1), який було витрачено на титрування Іридію, і об’єм розчину (V2), який було витрачено на титрування загальної кількості Іридію та Паладію. Різниця V2- V1- це об’єм тіооксину, витрачений на титрування Паладію.
 мл.
мл.

Рис. 6.3. Залежність сили струму від об’єму титранту
Масові частки Іридію та Паладію розрахуємо за рівняннями
 %,
%,
 %.
%.
Дата добавления: 2018-04-05; просмотров: 1219; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
