N.8. Исследование кариотипа применяется в тех случаях, когдахро-
мосомнаяаномалия может предполагатьсякак наиболее вероятный
этиологический фактор патологии в семье.
Исследование полового хроматина в буккальном мазке в настоящее время используется редко в связи с малой информативностью- Он применяется тогда, когда нет возможности провести анализ кариотипа.
Биохимический метод в отличие от цитогенетического не является специфическим для медико-генетической консультации. Биохимические исследования проводятся для определения характера наследственного дефекта, уточнения типа заболевания и выявления носителей патологического гена. Предположить наличие у больного наследственного дефекта обмена можно при наличии умственной отсталости (изолированной или в сочетании с патологией других органов и систем) или различных нарушений психического статуса; нарушений физического развития у детей; судорог, мышечной гипо- и гипертонии; нарушений походки и координации; гипо- и гиперпигментации, фоточувствительности;
желтухи; непереносимости отдельных пищевых продуктов и лекарственных препаратов; нарушении пищеварения (частая рвота, диарея, потеря аппетита, жирный стул, гепато- и спленомегалия, гингивиты); необычном запахе и цвете мочи;
гемолитической анемии.
Диагностика гетерозиготного носительства с помощью биохимических методов исследования имеет большое значение для прогноза потомства, профилактики заболевания. Выявление носительства патологического гена представляет значительный интерес даже в тех случаях, когда ребенку не угрожает наследование данного рецессивного заболевания. Это имеет место в тех случаях, когда гетерозиготным носителем является только жена, а муж здоров. Такие вопросы обычно возникают при обследовании сестер женщин, у которых родился ребенок с рецессивным заболеванием. Если имеется гетерозиготное носи-тельство только у жены, то часто во время беременности у таких женщин плод страдает из-за влияния на него различных метаболитов, образующихся в результате генетически детерминированного нарушения обмена у гетерозиготной носительницы, Так, например, доказано, что при гетерозиготном носительстве фенилкетонурии, уженщин во время беременности часто повышается содержание фенилаланина, что не безвредно для плода. У таких женщин отмечено увеличение частоты самопроизвольных выкидышей. Известно также, что у матерей. страдающих диабетом, весьма часто рождаются дети С пороками развития, тя-
|
|
|
158

желыми диабетическими фетопатиями, особенно, если не проводится соответствующая терапия во время беременности,
Иммуногенетические методы применяют для обследования пациентов и их родственников при подозрении на иммунодефицитные заболевания (агам-маглобинемия, атаксия-телеангиэктазия и др.), при подозрении на антигенную несовместимость матери и плода, при необходимости изучения генетических маркеров для определения наследственного предрасположения к болезни. Особое значение при исследовании заболеваний с наследственным компонентом приобрело в последние годы определение Н1-А-антигенов лейкоцитов крови. Наряду с изучением ассоциаций антигенов этой группы с заболеваниями, Н1-А-типирование используется для пренатальной диагностики некоторых наследственных заболеваний, например, адреногенитального синдрома.
|
|
|
В настоящее время успешно развивается молекулярно-генетический метод исследования (ДНК-зондовая диагностика). Этот метод является весьма перспективным в связи с возможностью высокоинформативной и быстрой диагностикой большой группы заболеваний. Он позволяет также выявить гетерозиготное носи-тельство, что важно при проведении пренатальной диагностики таких заболеваний как гемофилия, миопатия Дюшенна, хорея Гентингтона, врожденная гиперплазия коры надпочечников, муковисцидоз, а также при некоторых хромосомных нарушениях. Несомненно, в дальнейшем этот метод займет одно из ведущих мест, т.к. спектр диагностируемых заболеваний постоянно расширяется.
|
|
|
N.3. Таким образом, медико-генетическое консультирование является составной частью комплекса мероприятий, направленных на охрану здоровья матери и ребенка, на снижение перинатальной смертности.
Пренатальная диагностика
Пренатальная диагностика является наиболее эффективным средством профилактики наследственной патологии. Она позволяет отойти от вероятностного прогноза и однозначно решить вопрос о возможном поражении плода. Выявление аномального плода и последующее прерывание беременности позволяют многим женщинам, у которых риск рождения тяжело больного ребенка велик, решиться на повторную беременность.
В настоящее время основными методами пренатальной диагностики являются ультразвуковое исследование, определение уровня ал ьфа-фе то протеина, эстриола, хорионического гонадотропина и 17-гидроксипрогестерона в сыворотке крови матери, амниоцентез в I и II триместрах беременности, биопсия ворсин хориона и плаценты, получение крови и кожи плода (4,5,6,7).
Ы.В. Ряд методов пренатальной диагностики используются как скри-нирующие, и их следует применять всем беременным женщинам. К этим методам относятся: ультразвуковое исследование, определение альфа-фетопротеина, эстриола,хорионического гонадотропина и 17-гидроксипрогестерона в сыворотке крови матери и определение кариотипа плода по клеткам хориона, плаценты, крови или ам-ниотической жидкости у женщин старше 35 лет.
|
|
|
Использование только этих 3-х технологий дает возможность снизить число рождений детей с наследственной и врожденной патологией плода прибли-
159
зительно на 30%. Следует подчеркнуть, что эффективность таких исследований пропорциональна полноте охвата ими беременных. При полном охвате можно снизить частоту хромосомной патологии на 40—45%, дефектов нервной трубки на 85—90% (8).
Особое место в пренатальной диагностике занимает ультразвуковое исследование. Анализ врожденных пороков развития плода, диагностированных с помощью ультразвукового исследования во время беременности, показал четкую зависимость между характером порока и сроком его выявления (табл. 2.6-2). Установлено, что ряд пороков можно диагностировать уже в конце 1 — началеII триместра беременности. К таким порокам развития относятся анэнцефалия, голопрозэнцефалия, экзэнцефалия, лимфангиомы шеи, ом-фалоцеле, гастрошизис, неразделившиеся плоды, амелия, ахондрогенез , типа, аморфный плод при многоплодной беременности. Точность диагностики этих пороков развитияво 11—111 триместрах беременности приближается к 100%. Проведенные нами исследования показали, что точность диагностики врожденных пороков развития во всей популяции составляет 87%, в группе повышенного риска — 90%. Ложноотрицательные результаты в основном обусловлены проведением исследования до появления видимых анатомических изменений, наличием небольших пороков развития (чаще всего сердца лицевой части черепа, дистальных отделов конечностей), положением плода, затрудняющим визуализацию его отдельных органов или частей, недостаточно тщательным проведением исследования.
Взаимосвязь между пороком развития и сроком его выявле;
| Система | Срок беременности (в неделях)
| |||
| органов | ДО 12 | 13-20 | 21—28 | 29-40 |
| ЦНС | ацефалия, | черепно-и | крупные поро | микроцефалия |
| анэнцефалия, | спинномозговые | ки головного | мелкие пороки | |
| экзэнцефалий | грыжи | мозга и лице | головного моз | |
| иниоцэфалия | гидроцефалия | вого черепа, | га и лицевого | |
| расщелины | черепа | |||
| спинного мозга, | ||||
| верхней губы | ||||
| и неба | ||||
| Желудочно- | омфалоцвле, | атрезия | макроглоссия, | |
| кишечный | гастрошизис, | пищевода, | атрезия | |
| тракт | агенезия | 12-перстной | кишечника, | |
| желудка | кишки, | нелерфориро- | ||
| гепатомегалия, | ванный анус | |||
| агенезияжелч | ||||
| ного пузыря, | ||||
| диафрагмаль- | ||||
| ная грыжа | ||||
| Мочевыдели- | аганезия обеих | агенезия одной | экстрофия | |
| тельная | почек, | почки, | мочевого | |
| система | мультикистоз | дистопия почек, | пузыря | |
| поликистоз | атрезия уретры | |||
| и мочеточника, | ||||
| гидронефроз | ||||
160

Продолжение табл.2.6-2
| Система
| Срок беременности (в неделях)
| |||
| ДО 12 | 13-20 | 21—28 | 29-40 | |
| Сердечно | нарушение | крупные пороки | мелкие пороки | |
| сосудистая | ритма | сердца, | сердца и круп | |
| система | транспозиция | ных сосудов | ||
| сосудов, | ||||
| гидроперикард | ||||
| Костная | ахондрогенез | амелия, | артрогрипоз, | синдактилии, |
| система | 1 типа | ахондроплазия | деформации | отсутствие |
| отдельных | ||||
| костей | ||||
| Множествен | сросшаяся | лимфангиомы, | различные | различные |
| ные пороки | двойня, | тератомы, | сочетания | сочетания |
| развития | аморфный плод, | сиреномелия | системных | системных |
| лимфангиома | пороков | пороков | ||
Поданным литературы общее число ложноотрицательных результатов равно 8,5%, а ложноположительных — 5,3%, Специфичность метода составляет 94,7%, а чувствительность—91,5% (9).
При гидроцефалии наблюдается увеличение размеров головки плода по сравнению с размерами его туловища в сопоставлении с предполагаемым сроком беременности. Отмечается также увеличение скорости ее роста при динамическом наблюдении. Диагноз гидроцефалии не вызывает сомнения, если би-париетальный диаметр головки превышает 11 см. Однако иногда может встречаться так называемая «скрытая» гидроцефалия, т.е. не сопровождающаяся заметным увеличением размеров головки плода. В этих случаях особое внимание следует обращать на боковые желудочки и рога боковых желудочков мозга. Увеличение этих структур мозга также свидетельствует о наличии гидроцефалии.
Микроцефалия является пороком центральной нервной системы, выявление которого даже в III триместре беременности представляет значительные трудности. Это связано с выраженными индивидуальными особенностями раз-меров головки плода. Наиболее надежным диагностическим признаком микроцефалии является отставание б и париетального размера по сравнению со средней теоретической величиной, характерной для данного срока беременности, более чем на 4,5 недели при одновременном отсутствии отставания в размерах грудной клетки и живота плода. Резко выраженное снижение или почти полное прекращение роста бипариетального размера головки плода также свидетельствует о наличии микроцефалии. Помимо величины бипариетального размера следует учитывать лобнозатылочный размер и окружность головки, которые в совокупности позволяют дать более объективную оценку состояния плода.
Мозговые грыжи наблюдаются в различных местах черепа, однако наиболее часто и особенно крупные дефекты встречаются в области затылка. На эхо-граммах при наличии этой патологии выявляется округлой или овальной формы образование, интимно связанное с черепом плода.
Небольшое расщепление позвоночника (зрша ЫПоа) обнаруживается с трудом. При использовании ультразвукового метода исследования в основном диагностируются значительные дефекты позвоночника, сопровождающиеся выпячиванием наружутвердой мозговой оболочки (10).
6-1951 161
Я.В. Отсутствие эхографического изображения врожденного порока развития при первом или повторном ультразвуковом исследовании еще не исключает его обнаружения в более поздние сроки. В связи с этим для своевременной диагностики врожденных пороков развития плода необходима четкая организация ультразвукового обследования: его проводят всем беременным не менее 3 раз в течение беременности (в 10—12, 20—22 и 30— 32 недели), а по показаниям (анамнез или подозрение на порок развития плода) — с большей кратностью (через каждые 3—4 недели) и тщательным исследованием всех органов и систем плода.
В настоящее время важную роль в выявлении женщин «групп риска" по рождению детей с врожденной и наследственной патологией имеет определение альфа-фетопротеина, хорионического гонадотропина, эстриола и 17-гид-роксипрогестерона (АФП, ХГ,ЕЗ,17-ОП) в сыворотке крови матери (11).
N.8. Оптимальными сроками для проведения исследования АФП, ХГ,Еу 17-ОП являются 16—20 недели беременности.
Ал ьфа-фето протеин представляет собой гликопротеин с молекулярной массой 65 кДа. Синтез АФП у плода начинается с 5 недели беременности в желточном мешке, затем в печени и желудоч но-кишечном тракте. В кровь беременной поступает через плаценту и непосредственно из амниотической жидкости. Проникновение АФП в кровоток матери зависит от функции почек и желудочно-кишечного тракта плода, а также от проницаемости плацентарного барьера. Содержание АФП в крови беременной начинает нарастать с 10 недели беременности, максимальная концентрация определяется в 32—34 недели, послечегоего содержание снижается (рис,2.6-1).
| Рис. 2.6-1. Норм; матер! |

162

Хорионический гонадотропин — это гликопротеид с молекулярной массой 37,9 кДа. Состоит из двух субьединиц — альфа и бета, из которых только бета-цепь специфична для данного гормона. Образуется в клетках синцитио- и цито-трофобласта. Синтез гормона начинается с момента имплантации зародыша, неуклонно нарастает, достигая максимального содержания в 8—10 недель беременности, после этого быстро снижается и держится на протяжении оставшегося срока на уровне 5000—50000 МЕ/л (рис2.6-2).
| 200; | '
| ||
| 180 |
| ||
| 160 |
| ||
| „ 140 |
| ||
| 0 |
| ||
| ^ 120 |
| ||
| § 100 |
| ||
| Е 80 | I |
| |
| X |
| ||
| 60 | \ 1 | ||
| ^ | |||
| 40 20
| /
| Ч
| л-^^ |
10 20 30 40
Срок беременности, нед. Рис 2.6-2. Нормативные показатели концентрации ХГ в сыворотке крови матери
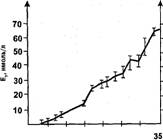
Неконъюгированный эстриол — стероидный гормон, в организме беременной синтезируется комплексом плацента-плод из метаболитов холестерина матери. Определяемый в сыворотке крови беременной эстриол, является результатом синхронной деятельности плаценты и надпочечников плода. При нормально развивающейся беременности продукция эстриола повышается в соответствии с увеличением срока беременности и ростом плода (рис. 2.6-3).
Количественное содержание уровней маркеров (АФП,ХГ,Е,> может меняться в различных популяциях и этнических группах населения и зависит от метода определения. Поэтому индивидуальные уровни маркеров у беременных следует оценивать с помощью показателя МоМ (МиЙ1р!е оТ МесНап). Этот показатель представляет собой отношение индивидуального значения маркера к медиане соответствующего нормативного ряда, установленной для определенной популяции.
N.В. Нормальными значениями сывороточных маркеров длялюбогосрока беременности принято считать показатели МоМ от 0,5 до 2,0.
Повышение содержания ал ьфа-фето протеи на в сыворотке крови беременных дает возможность выделить среди них женщин с риском развития открытого порока центральной нервной системы плода (расщелина спинного мозга, анэнцефалия и др.).
б- 163
5 15 25
Срок беременности, нсд.
Рис. 2.6-3. Нормативные показатели концентрации эстриола в сыворотке крови матери в зависимости от срока беременности.
N.8. При наличии высокого уровня АФП в сыворотке крови диагноз уточняется с помощью ультразвукового исследования и определения альфа-фетопротеина в амниотической жидкости.
Установлена взаимосвязь между снижением содержания альфа-фетопротеина в сыворотке крови матери и синдромом Дауна у плода.
N. В. Обнаружение в сыворотке крови беременной низкого уровняаль -фа-фетопрогеина в сочетании с увеличением содержанияхориони-ческого гонадотропина и уменьшением уровня эстриола является показанием для проведения амниоцентеза или кордоцентеза с последующим определением кариотипа плода.
Используемые сывороточные маркеры не являются специфичными для синдрома Дауна, поэтому не все случаи синдрома Дауна у плода сопровождаются подобными отклонениями уровней маркеров. Кроме того, эти изменения могут наблюдаться при других патологических состояниях плода, сопутствующей акушерской патологии у матери и даже у здорового плода. Вероятность выявления синдрома Дауна обычно не превышает 60—70% (12).
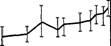
Для выделения беременных высокого риска на рождение ребенка с адре-ногенитальным синдромом нами был предложен как скринирующий метод определения 17-гидроксипрогестерона в сыворотке крови матери (нормативные показатели представлены на рис. 2.6-4).
N.В. При повышении концентрации этого маркера в сыворотке крови матери необходимо проведение инвазивной пренатальной диагностики с последующим исследованием 17-гидроксипрогестерона в амниотической жидкости.

25-20-
| 10. 5 - |
| 40 |
-Г 10 20 30
Срок беременности, нед.
Рис. 2.6-4. Нормативные показатели концентрации 17-ОП в сыворотке крови матери в зависимости от срока беременности.
Инвазивными методами пренатальной диагностики являются биопсия хориона, амниоцентез, плаце нтоцентез, кордоцентез и биопсия кожи плода.
Инвазивная пренатальная диагностика обоснована и целесообразна тогда, когда имеется вероятность рождения ребенка с тяжелым наследственным заболеванием, лечение которого невозможно или малоэффективно; риск рождения больного ребенка выше риска осложнений после применения методов пренатальной диагностики; существует точный тест для пренатальной диагностики и имеется лаборатория, оснащенная необходимой аппаратурой и реактивами; имеется согласие консультируемой семьи на прерывание беременности.
N. В, Суть современной инвазивной пренатальной диагностики состоит в том, что если существует маркер (цитогенетический, биохимический, молекулярно -генетический, иммунологический, гормональный и др.), на основании которого можно поставить диагноз заболевания в постнатальном периоде, то используя тот же маркер можно определить врожденную и наследственную патологию и во время беременности у плода.
Основными показаниями к инвазивной пренатальной диагностике являются структурная перестройка хромосом у одного из родителей; возраст матери старше 35 лет; рождение ранее ребенка с множественными врожденными пороками развития; пренатально диагностируемые моногенные заболевания.
Относительными показаниями следует считать отягощенный акушерский анамнез, осложненное течение данной беременности (угроза выкидыша, мно-говодие, гипотрофия плода), проведение рентгенологических процедур, прием лекарственных препаратов, инфекционные заболевания во время беременнос-
165
ти. Оценка степени риска при этих ситуациях и объем пренатальной диагностики нуждаются в дальнейшем изучении.
Инвазивная пренатальная диагностика осуществляется с 7 недель беременности с помощью биопсии хориона. Впервые биопсия хориона с диагностической целью была выполнена нами в конце 70-х годов (13), В настоящее время исследование ткани хориона позволяет осуществить диагностику широкого спектра хромосомных и генных заболеваний.
Кариотип плода можно получить по клеткам хориона с помощью культивирования и "прямым" методом. При этом возможны ошибки, обусловленные загрязнением образцов материнскими клетками, мозаицизмом клеток плода, физиологической полиплоидией.
Пренатальнуго диагностику наследственных болезней обмена, гемогло-бинопатией и сцепленных с Х-хромосомой заболеваний осуществляют на основе анализа ДНК, выделяемой из ткани хориона, после предварительного моле-кулярно-генетического обследования родителей и больного ребенка. Если таким образом провести диагностику невозможно (отсутствуют ДНК-зонды или больной ребенок умер), определяют в культуре клеток ткани хориона содержание соответствующего фермента или ограничиваются определением пола плода (при Х-сцепленной патологии).
Способы получения ворсин хориона могут быть условно разделены на несколько групп: биопсией (щипцами, пинцетом), аспирацией (специальным катетером или иглой) в сочетании с эндоскопией. Наиболее распространенными из них являются: трансцервикальная биопсия щипцами, трансцервикальная аспирация специальным катетером (например, трофоканом), трансабдоминальная аспирация с использованием иглы (хориоцентез) (14,15).
Условиями для проведения процедур, связанных с получением ткани хориона, являются 1 —2 степень чистоты влагалищного отделяемого, отрицательные реакции Вассермана, на СПИД, гепатит В и С, нормальные анализы крови и мочи, предварительное ультразвуковое исследование. Эхография позволяет установить локализацию и толщину ветвистого хориона, измерить расстояние от наружного и внутреннего зева до нижнего края хориона, для выбора направлений и глубины введения инструмента, выявить различные отклонения в развитии беременности (неразвивающаяся беременность) и уточнить ее срок.
Проведение манипуляции противопоказано при наличии клинических симптомов прерываний беременности, острых инфекционных заболеваниях, наличии инфекции в половых путях, опухолевидных образований матки больших размеров.
Оптимальный срок выполнения процедур соответствует 8—11 неделям беременности со дня последней менструации. Немаловажным фактором, влияющим на успешность проведения биопсии, является толщина хориона, которая должна быть не менее 1 см. Для лабораторного исследования необходимо не менее 5 мг хориона.
Процедуры выполняют в амбулаторных условиях, по показаниям — в стационаре, под контролем эхографии с последующим ультразвуковым исследованием через 3 часа-
Основными осложнениями процедуры является угроза прерывания беременности. Она может быть обусловлена нарушением целостности плодного яйца, инфицированием или образованием гематомы после проведения манипуляции. В настоящее время частота этих осложнений значительно снизилась в результате проведения биопсии под ультразвуковым контролем и не превышает 2—3%.

Методика трансцервикальной биопсии хориона щипцами (рис. 2.6-5), После обработки наружных половых органов дезинфицирующим раствором (йод и спирт или хлорамин) обнажают при помощи зеркал шейку матки, обрабатывают влагалище, шейку матки и наружную часть цервикального канала йодом или спиртом и фиксируют переднюю губу щипцами. Без предварительного расширения цервикального канала биопсийные щипцы 01углриз РВ-15С (Япония) с наружным диаметром 2 мм, с замкнутыми браншами осторожно, по линии наименьшего сопротивления, вводят в полость матки в нужном направлении. После достижения хориона щипцы раскрывают, продвигают вперед на 2—3 мм и проводят биопсию. После извлечения щипцов стерильной иглой удаляют биоптат и тщательно его осматривают. При осмотре достаточно просто можно определить в био-птате ткань хориона, которая представляет собой легко растяжимую белесоватую волокнистую ткань. Среднее количество хориона, получаемого при трансцервикальной биопсии составляет 12 мг(рис. 2.6-6). Значительные трудности в получении хориона данным методом возни кают тогда, когда хорион расположен высоко на передней стенке или в дне матки,

Рис. 2.6-5. Трансцервикальная биопсия хориона. Бор. 10 нед.
1. плодное яйцо 3. биопсийные щипцы
2. хорион на передней стенке матки 4. матка
Методика трансцервикальной аспирации хооиона. В асептических условиях (обработка дезинфицирующим и растворами производится также, как и при трансцервикальной биопсии) шейку матки обнажают зеркалами и пулевыми щипцами фиксируют переднюю губу. Без предварительного расширения цервикального канала трансцервикально в полость матки вводят одноразовый аспирационный катетер (трофокан) Роггех (Англия) с наружным диаметром 1,45 мм и длиной 210 мм, который способен изменять свою конфигурацию.После достижения выбранного участка хориона обтуратор из гибкого
167
катетера извлекают, К катетеру присоединяют шприц емкостью 20 мл, содержащий 1—2 мл питательной среды с гепарином. Продвигая на 1—2 мм катетер в толщу хориона и одновременно выдвигая поршень шприца для создания в нем отрицательного давления, производят аспирацию ворсин. После поступления их в канюлю, что контролируется ультразвуковым исследованием, инструмент удаляют из полости матки, удерживая при этом отрицательное давление в шприце до момента полного извлечения. Полученный материал из шприца помещают в стерильную емкость со средой для дальнейшего анализа. Среднее количество хориона, получаемого при трансцервикальной аспирации, составляет 20 мг. Однако довольно часто (около 80%) при этом доступе ткань хориона имеет значительную примесь децидуальных (материнских) клеток.

А, Трансабдоминальный хориоцентез, 8 мг Б. Трансцервикальная биопсия щипцами, 12 мг.
Методика трансабдоминальнои_биопсии хориона иглой (хориоцентез) (рис. 2.6-7). Переднюю брюшную стенку обрабатывают раствором хлорамина и 70% спирта. Под контролем эхографии выбирают место пункции так, чтобы после прохождения передней брюшной стенки и стенки матки пунктировать толщу хориона. Затем проводят прокол иглой 180 или 200, длиной15— 20 см. Удалив мандрен и фиксируя при этом иглу в выбранном участке ткани, подсоединяют шприц с раствором гепаринизированной питательной среды. Извлекая из тол щи хориона иглу, одновременно создают отрицательное давление в шприце выдвижением поршня. После удаления иглы место пункции обрабатывают спиртом и проводят исследование полученной ткани, количество которой в среднем составляет 8 мг (рис, 2.6-6). Применение этого доступа затруднительно при расположении хориона на задней стенке матки в сочетании с ее ретрофлексией.
В том случае, если с первой попытки не удалось получить биоптат хориона, можно произвести вторую и, при благоприятной акушерской ситуации, даже третью попытку. Если же и она оказалась неудачной, следующую биопсию можно повторить не ранее чем через 3—4 дня после ультразвукового исследования.

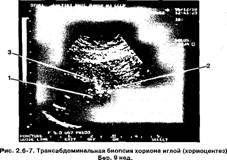
1. плодное яйцо
2. хорион на правой боковой стенке матки
3. пункционная игла
Методика получения ткани хориона в настоящее время является основной для проведения пренатальной диагностики в 1 триместре беременности. Однако для проведения процедур необходимы технические навыки и специальное оснащение. Кроме того, в некоторых случаях получение хориона затруднено или невозможно, а риск рождения аномального ребенка высок. В таких случаях возможно использование ран него амниоцентеза (16). При исследовании амниотической жидкости можно определить кариотип плода; уровень содержаний некоторых ферментов, гормонов, альфа-фетопротеина; провести анализ ДНК.
Нами установлено, что в I триместре беременности (8—12 недель) по культуре клеток амниотической жидкости можно получить кариотип плода только в 68% наблюдений. Наиболее успешно амниоцентез в 1триместре был применен для пренатальной диагностики врожденной гиперплазии коры надпочечников, обусловленной недостаточностью 21 -гидроксилазы. Определение в амниотической жидкости 17-гидроксипрогестерона — гормонального маркера недостаточности21 -гидроксилазы обнаружило достоверное повышение его концентрации при заболевании плода уже в 8—9 недель беременности. Эти показатели четко коррелируют с данными, полученными в 18—20 недель беременности, т.е. в обычные сроки пренатальной диагностики врожденной гиперплазии коры надпочечников плода.
Условия, противопоказания и сроки выполнения раннего амниоцентеза такие же, как при получении ткани хориона. Основным осложнением является прерывание беременности, однако его частота не превышает 1— 2%.
Методика трансабдоминального амниоиентеза(рис. 2.6-8) Процедуру проводят в амбулаторных условиях под контролем эхографии. Переднюю брюшную
стенку обрабатывают раствором хлорамина и 70% спирта. Под контролем ультразвука пунктируют переднюю брюшную стенку и стенку матки иглой 200 или 220. После удаления мандрена шприцем извлекают 2—3 мл околоплодных вод. Отсоединив шприц, вводят мандрен и извлекают иглу. Место прокола обрабатывают 70% спиртом. Через 2 часа после проведения процедуры, в течение которых пациент находится под наблюдением медицинского персонала, осуществляют контрольное ультразвуковое исследование,

Рис. 2.6-в. Трансабдоминальный амниоцентез в 1 триместре беременности. Бер. 11нед,
1. амниотическая полость
2. эгзоцеламическая полость
3. пункционная игла
4. хорион на передней стенке матки
Исследование амниотической жидкости возможно и в более поздние сроки беременности, оптимальным из которых являются 17—20 недель. Амниоцентез во втором триместре беременности получил наиболее широкое распространение (рис. 2.6-9), Показания для его проведения, условия, противопоказания, характер возможных осложнений и методика аналогичны раннему амниоцентеэу. Количество извлекаемой амниотической жидкости в среднем составляет 30 мл. Исследуя ее, можно диагностировать хромосомную патологию плода; некоторые аутосомно-ре-цессивные заболевания и наследуемые сцепленно с полом; пороки развития центральной нервной системы по уровню содержания альфа-фетопротеи на.
Амниоцентез с последующим исследованием амниотической жидкости имеет один существенный недостаток. Дли диагностики некоторых наследственных заболеваний (в частности, хромосомной патологии и ряда болезней обмена) требуется культивирование клеток амниотической жидкости. Это удлиняет время диагностики на 2—3 недели, а иногда, приблизительно в 5% наблюдений, не позволяет поставить диагноз, Определенные проблемы возникают в тех случаях, когда в амниотическую жидкость попадает кровь матери. После этого, как правило, приходитсяиспользовать метод кордоцентеза.
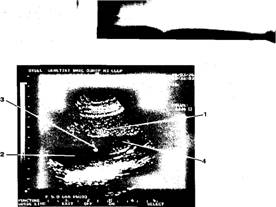
Рис. 2,6-9. Трансабдоминальный амниоцентез во II триместре беременности. Бер. 18 нед.
1. плацента на передней стенке матки
2. амниотическая полость
3. пункционная игла
4. плод
Получение крови плода во II триместре беременности возможно для диагностики многих наследственных заболеваний (в том числе болезней крови), им-мунодефицитных состояний. По лимфоцитам крови плода в течение нескольких дней можно установить кариотип (6). Вне зависимости от срока беременности это необходимо делать и тогда, когда при ультразвуковом исследовании диагностированы пороки развития у плода. Это дает возможность решать вопрос о целесообразности проведения внутриутробной или постнатальной коррекции и о методе родоразрешения.
Процедура противопоказана при наличии симптомов прерывания беременности, больших опухолевидных образований матки и придатков, острых инфекционных заболеваний,
Получение крови плода проводят в амбулаторных условиях, начиная с 17 недель беременности, под постоянным контролем эхографии. Характер и частота осложнений зависят от техники, используемой для получения крови плода. Наиболее частым является самопроизвольный выкидыш, что наблюдается в 1—2% (17).
В настоящее время основным методом получения крови плода является кордоцентез(18). Оптимальным сроком для его проведения являются22—24 недели беременности.
Методика кордоцентеза (рис. 2.6-10). В начале осуществляют трансабдоминальный амниоцентез, а затем под контролем эхографии пунктируют вену пуповины вблизи места ее отхождения от плаценты. Пункцию проводят иглой 200 или220, после ее обработки раствором стерильного цитрата натрия или гепа-рина. В присоединенный к игле шприц, обработанный тем же раствором, извлекают 3—5 мл крови. При неудачной попытке, что имеет место при плохой визуа-

Таблица 2.6-3
Дата добавления: 2018-02-28; просмотров: 276; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
