Релятивистік динамика элементтері 13 страница
Көптеген эксперименттердің нәтижелерін талдай отырып, ғалымдар екінші текті мәңгіқозғалтқыш жасау мүмкін емес деген тұжырымға келді. Бұл тұжырымдама термодинамиканың екінші бастамасы деген аталды.
Термодинамиканың екінші бастамасының өзара эквивалент бірнеше тұжырымдама бар. Келесі екі тұжырымдаманы талдайық:
1) жылуды толығымен жұмысқа айналдыратын периодты жылу машинасын жасау мүмкін емес
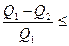
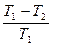 ; (9.15)
; (9.15)
2) жылу өздігінен температурасы жоғары денеден температурасы төмен денеге ғана өтуі мүмкін
 . (9.16)
. (9.16)
Бірінші формула екі тұжырымдаманы да түсіндіреді. Егер 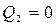 болса (машина суытқышқа жылу бермесе), онда
болса (машина суытқышқа жылу бермесе), онда 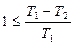 , яғни, T2 = 0, бірақ абсолюттік нөлге тең температура алу мүмкін емес.
, яғни, T2 = 0, бірақ абсолюттік нөлге тең температура алу мүмкін емес.
Егер 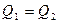 болса (жұмыс денесі қыздырғыштан алған жылу мөлшерін толығымен суытқышқа берсе), онда
болса (жұмыс денесі қыздырғыштан алған жылу мөлшерін толығымен суытқышқа берсе), онда 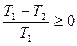 , яғни,
, яғни, 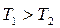 және
және  . Бұлай болуы мүмкін емес.
. Бұлай болуы мүмкін емес.
Термодинамиканың екінші бастамасы бірінші бастама секілді барлық жағдайда орындалатын әмбебап заң емес. Термодинамиканың бірінші бастамасы жылулық процестерге арналған энергияның сақталу заңы болағандықтан, оны кез-келген жүйе үшін қолдануға болады. Ал термодинамиканың екінші бастамасын өлшемдері шектеулі оқшауланған жүйелерге ғана қолдануға болады.
|
|
|
Әдебиеттер:
Негізгі: 1 [337-366], 2 [125-141], 3 [165-181].
Қосымша: 12 [96-103].
Бақылау сұрақтары:
1. Қайтымды және қайтымсыз процестердің қандай айырмашылықтары бар?
2. Нақты процестер неліктен қайтымсыз болады?
3. Карно циклін 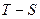 диаграммада график түрінде көрсет.
диаграммада график түрінде көрсет.
4. Тұйық жйне тұйық емес жүйелердің энтропиясы қалай өзгере алады?
10-дәріс
Нақты газдар мен булар
Абстракциялық идеал газ ұғымын енгізу молекула-кинетикалық теорияны жасауға, тасымалдау құбылыстарын зерттеуге, жылусыйымдылықтарды есептеу мәселесін шешуге т.б. мүмкіндік берді. Төменгі қысымдар мен температураларда бұл теорияның қорытындылары эксперимент нәтижелерін жақсы түсіндіреді.
Қысым үлкен болғанда газ қатты сығылып, молекулалардың көлемдерінің қосындысы газдың көлемімен шамалас болады. Сонымен қатар, молекулалардың бір-бірінен қашықтығы молекуааралық күштер әсер ететін шамаға дейін азаяды.
10 Ван-дер-Ваальс теңдеуі
|
|
|
Нақты газдардың күй теңдеуінде молекулалардың көлемі мен молекулааралық күштер ескерілуі керек. Сондықтан голландиялық физик Ван-дер-Ваальс идеал газ күйінің теңдеуіне екі түзету енгізді. Сол түзетулерді талдайық.
10.1 Молекула көлемін ескеру
Бөлшектер қатты жақындағанда олардың тебу күштері арта бастайды. Молекулалар бір-біріне кеңістіктегі алып тұрған орындарынан жақын орналаса алмайды. Сондықтан, газдың көлемі молекулалардың санына пропорционал b шамаға кем болу керек. Бір моль газдың көлемі келесі шамаға тең болады:
( 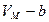 ). (10.1)
). (10.1)
Шар тәрізді молекулаларды барынша тығыз орналастырса да, олардың арасында қуыстар қалады. Олай болса, 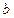 тұрақтысы бір моль газдағы барлық молекулалардың көлемдерінің қосындысынан әрқашан артық болады.
тұрақтысы бір моль газдағы барлық молекулалардың көлемдерінің қосындысынан әрқашан артық болады.
10.2 Молекулалардың тартылыс күшін ескеру
Молекуалардың өзара тартылыс күші газ ішінде ішкі қысым деп аталатын қосымша қысым тудырады. Сондықтан күй теңдеуіндегі р қысымды (p+p1) шамасымен ауыстыру керек. Ван-дер-Ваальстің зерттеулері ішкі қысым молекулалар концентрациясының квадратына тура, мольдік көлем (  ) квадратына кері пропорционал болатынын көрсетті:
) квадратына кері пропорционал болатынын көрсетті:
|
|
|
 , (10.2)
, (10.2)
мұндағы а – газдың табиғатына тәуелді болатын тұрақты шама. Осы екі түзетуді Клапейрон теңдеуіне енгізсек, нақты газдың бір молі үшін күй теңдеуін аламыз ( Ван-дер-Ваальс теңдеуі):
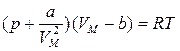 . (10.3)
. (10.3)
Газдың кез-келген мөлшеріне (  ) арналған күй теңдеуінің түрі:
) арналған күй теңдеуінің түрі:
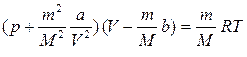 , (10.4)
, (10.4)
мұндағы  мен
мен 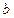 – эксперимент арқылы анықталатын тұрақты шамалар;
– эксперимент арқылы анықталатын тұрақты шамалар;  – газ алып тұрған көлем. Ван-дер-Ваальс теңдеуін шығарарда бірқатар оңайлатулар енгізілгендіктен, бұл теңдеу нақты газ күйін жуықтап сипаттайды. Нақты газ күйін сипаттайтын басқа да теңдеулер бар. Бірақ олар күрделі болғандықтан мұнда қарастырылмайды.
– газ алып тұрған көлем. Ван-дер-Ваальс теңдеуін шығарарда бірқатар оңайлатулар енгізілгендіктен, бұл теңдеу нақты газ күйін жуықтап сипаттайды. Нақты газ күйін сипаттайтын басқа да теңдеулер бар. Бірақ олар күрделі болғандықтан мұнда қарастырылмайды.
Дата добавления: 2022-01-22; просмотров: 111; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
