Релятивистік динамика элементтері 11 страница
8.4 – суретте 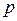 қысымның әртүрлі мәндеріндегі изобаралық процестер
қысымның әртүрлі мәндеріндегі изобаралық процестер  ,
, 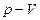 және
және  диаграммалары арқылы берілген. Газға изобаралық процесс кезінде берілетін шексіз аз жылу мөлшері
диаграммалары арқылы берілген. Газға изобаралық процесс кезінде берілетін шексіз аз жылу мөлшері 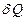 :
:
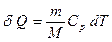 , (8.14)
, (8.14)
мұндағы 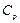 – газдың тұрақты қысымдағы мольдік жылу-сыйымдылығы. Тұрақты қысым үшін (
– газдың тұрақты қысымдағы мольдік жылу-сыйымдылығы. Тұрақты қысым үшін ( 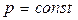 ) идеал газдың күй теңдеуінен (
) идеал газдың күй теңдеуінен (  ) дифференциал алсақ:
) дифференциал алсақ:  .
.
Олай болса:
 . (8.15)
. (8.15)
Термодинамиканың бірінші бастамасының (8.3) формуласына (8.9), (8.14) және (8.15) өрнектерді қойсақ:
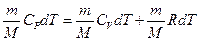 . (8.16)
. (8.16)
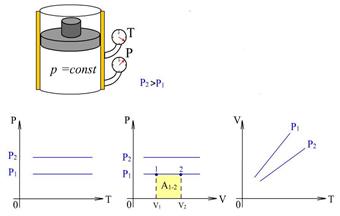 8. 4 – сурет. Қысымның әртүрлі мәндері үшін изобаралық процесс диаграммалары
8. 4 – сурет. Қысымның әртүрлі мәндері үшін изобаралық процесс диаграммалары
|
Егер (8.16) өрнектен бір моль зат үшін жылусыйымдылық үшін Майер теңдеуін алуға болады:
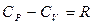 . (8.17)
. (8.17)
Бұл теңдеудің физикалық мағынасы: тұрақты қысымда бір моль газдың температурасын 1ºК арттырғандағы газдың жұмысы универсал газ тұрақтысына тең болады. Бір моль газға изобаралық процесс кезінде берілетін жылу мөлшері изохоралық процесс кезінде берілетін жылу мөлшерінен универсал газ тұрақтысына тең шамаға артық болады.
Газдың 1-2 изобаралық процесс кезінде жасайтын жұмысы
|
|
|

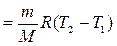 , (8.18)
, (8.18)
p-V диаграммасындағы боялған аймақтың ауданымен өлшенеді.
8.6.3 Изотермиялық процесс ( 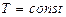 )
)
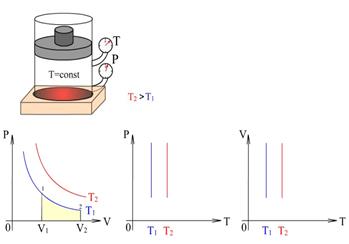 8.5 – сурет. Әртүрлі Т температура мәндері үшін изотермиялық процестердің диаграммалары
8.5 – сурет. Әртүрлі Т температура мәндері үшін изотермиялық процестердің диаграммалары
| Изотермиялық процесс деп тұрақты температурада өтетін термодинамикалық процестерді немесе олардың ұлғаюы немесе сығылуы кездерінде сыртқы орта мен газ арасындағы температура айрымы тұрақты болып қалатын процестерді айтады. Идеал газ күйінің теңдеуінің оң жағындағы шамалар тұрақты болғандықтан:
 . (8.19)
8.5 – суретте әртүрлі Т температураның мәндері үшін изотермиялық процестер . (8.19)
8.5 – суретте әртүрлі Т температураның мәндері үшін изотермиялық процестер 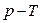 , , 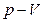 және және  диаграммалары арқылы берілген. диаграммалары арқылы берілген.
|
Бұл процесте идеал газдың ішкі энергиясы өзгермейді: 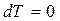 болғандықтан
болғандықтан  , сондықтан газға берілген жылу мөлшері толығымен сыртқы күштерге қарсы жасалатын жұмысқа кетеді:
, сондықтан газға берілген жылу мөлшері толығымен сыртқы күштерге қарсы жасалатын жұмысқа кетеді:
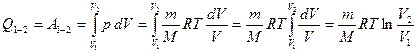 . (8.20)
. (8.20)
Жылу мөлшері 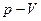 диаграммасындағы боялған ауданға тең болады. Изотермдік процесс
диаграммасындағы боялған ауданға тең болады. Изотермдік процесс 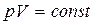 , яғни
, яғни  және
және 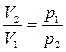 , сондықтан:
, сондықтан:
|
|
|
 . (8.20а)
. (8.20а)
8.6.4 Адиабаталық процесс ( 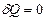 )
)
Адиабаталық процесс деп жүйелерде сыртқы ортамен жылу алмасусыз өтетін процестерді айтады. Газдар жылдам ұлғайғанда немесе сығылғанда жүйе қоршаған ортамен жылу алмасып үлгермейді. Сондықтан мұндай процестер адиабаталық деп аталады. Термодинамиканың бірінші заңы (8.3) бойынша адиабаталық процесс ( 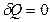 кезінде жүйе жұмысты ішкі энергия есебінен жасайды:
кезінде жүйе жұмысты ішкі энергия есебінен жасайды:
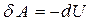 . (8.21)
. (8.21)
Бұл өрнекке (8.1) және (8.9) формулаларды қойсақ, онда газ көлемінің өзгергенде жасалатын жұмыс оның температурасының өзгеруімен қатар жүретінін көреміз:
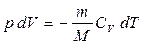 (8.22)
(8.22)
Өрнектегі минус таңбасы газ көлемі адиабаталық ұлғайғанда оның температурасы төмендейтінін көрсетеді.
Адиабаталық процестер Пуассон теңдеуімен сипатталады:
 , (8.23)
, (8.23)
мұндағы 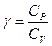 – адиабата көрсеткіші немесе Пуассон коэффициенті деп аталатын өлшем бірлігі жоқ шама. Адиабата теңдеуін басқа күй параметрлері арқылы да жазуға болады:
– адиабата көрсеткіші немесе Пуассон коэффициенті деп аталатын өлшем бірлігі жоқ шама. Адиабата теңдеуін басқа күй параметрлері арқылы да жазуға болады:
|
|
|
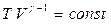 және
және  . (8.24)
. (8.24)
Өзара салыстыру үшін 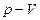 диаграммасына (8.6 – сурет) адиабата мен изотерма қисықтары бірге салынған.
диаграммасына (8.6 – сурет) адиабата мен изотерма қисықтары бірге салынған.  болғандықтан, адиабата қисығы изотермаға қарағанда тіктеу болады.
болғандықтан, адиабата қисығы изотермаға қарағанда тіктеу болады.
 8.6 – сурет. Адиабаталық процесс кезіндегі жұмыс
8.6 – сурет. Адиабаталық процесс кезіндегі жұмыс
| Оның себебі, адиабаталық сығылу кезінде (  процесс) қысым әрі көлемнің кішіреюінен, әрі сығылған газдың температурасының өсуінен артса, изотермиялық процесте ол тек көлемнің кішіреюінен ғана артады. Адиабаталық ұлғаю кезінде (1-2 процесс) газдың температурасы төмендейтіндіктен қысым изотермиялық процеспен салыстырғанда жылдамырақ кемиді. Адиабаталық процесс процесс) қысым әрі көлемнің кішіреюінен, әрі сығылған газдың температурасының өсуінен артса, изотермиялық процесте ол тек көлемнің кішіреюінен ғана артады. Адиабаталық ұлғаю кезінде (1-2 процесс) газдың температурасы төмендейтіндіктен қысым изотермиялық процеспен салыстырғанда жылдамырақ кемиді. Адиабаталық процесс 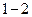 кезінде газдың жұмысы: кезінде газдың жұмысы:
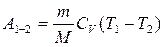 , (8.25)
8.6 – суретте боялған аймақ ауданымен анықталады. , (8.25)
8.6 – суретте боялған аймақ ауданымен анықталады.
|
Идеал газдың ішкі энергиясының формуласынан 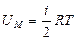 мольдік жылусыйымдылықтарды
мольдік жылусыйымдылықтарды  және
және  оңай анықтауға болады.
оңай анықтауға болады. 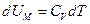 және
және 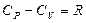 болғандықтан:
болғандықтан:

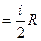
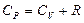
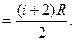 . (8.26)
. (8.26)
Олай болса, адиабаталық көрсеткіш келесі өрнекпен анықталады:
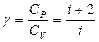 . (8.27)
. (8.27)
|
|
|
Молекуланың еркіндік дәрежесі оның құрамындағы атомдар санына байланысты. Бір атомды газдағы молекулалар тек ілгерілемелі қозғалыс жасайды, сондықтан оның еркіндік дәрежесі үшке тең. Екі атомды газ молекуласының айналмалы қозғалысын ескеру керек. Бірақ екі атомды қосатын түзуді айналып қозғалғанын ескермеуге болады. Сондықтан олардың еркіндік дәрежесі беске тең болады. Егер молекуладағы атом саны екіден артық болса, онда олардың еркіндік дәрежесі алты болады. 8.1 – кестеде еркіндік дәрежелері і әртүрлі идеал газдар үшін  ,
, 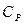 және
және 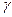 мәндері келтірілген.
мәндері келтірілген.
8.1 – кесте
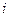
| 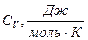
| 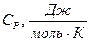
| 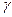
|
| 3 (біратомды газ) | 12,5 | 20,8 | 1,67 |
| 5 (екіатомды газ) | 20,8 | 29,1 | 1,40 |
| 6 (көпатомды газ) | 24,9 | 33,2 | 1,33 |
8.6.5 Политроптық процесс ( 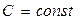 )
)
Политроптық процесс – деп С жылусыйымдылықтары өзгеріссіз өтетін термодинамикалық процестерді айтады. Политроп теңдеуінің түрі:
 , (8.28)
, (8.28)
мұндағы 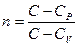 – политроп көрсеткіші (
– политроп көрсеткіші ( 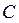 – берілген процесс үшін газдың жылусыйымдылығы). Жоғарыда келтірілген барлық изопроцестерді политроптық процестердің дербес түрлері ретінде қарастыруға болады. Егер,
– берілген процесс үшін газдың жылусыйымдылығы). Жоғарыда келтірілген барлық изопроцестерді политроптық процестердің дербес түрлері ретінде қарастыруға болады. Егер,
п=0 болса, онда (8.28) политроптық теңдеу изобаралық процесc ( 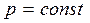 ),
), 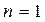 болса изотермиялық процесc (pV=const),
болса изотермиялық процесc (pV=const), 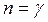 болса, адиабаталық процесс (pV
болса, адиабаталық процесс (pV 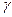 =const) теңдеулеріне айналады.
=const) теңдеулеріне айналады.
 8.7 – сурет Политроптық процесс
8.7 – сурет Политроптық процесс
|
Изохоралық процесс теңдеуін
 келесі түрде жазуға болады:
келесі түрде жазуға болады:
 . Осыдан:
. Осыдан:  болса
болса  болады.
болады.
Бұл процестер 8.7– суреттегі 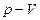 диаграммасында көрсетілген.
диаграммасында көрсетілген.
Әдебиеттер:
Негізгі: 1 [243-248, 269-278], 2 [95-125], 3[147-165].
Қосымша: 12[89-96].
Бақылау сұрақтары:
1. Идеал газдың ішкі энергиясына не жатады?
2. Ішкі энергия қандай параметрлермен анықталады?
3. Майер теңдеуінің физикалық мағынасы қандай?
4. Адиабата графигі изотерма графигіне қарағанда неге тіктеу болады?
9-дәріс
Термодинамиканың екінші бастамасы
Термодинамиканың бірінші бастамасы энергияның сақталу және түрлену заңдарын сипаттағанымен, оқшауланған термодинамикалық жүйелердегі процестің жүру бағытына шектеу қоймайды. Бірақ табиғатта белгілі шарттарды қанағаттандыратын процестер ғана кездеседі. Табиғатта қандай процестер жүруі мүмкін – деген сұраққа термодинамиканың екінші бастамасы жауап береді. Бұл бастама термодинамикалық процестердің жүру бағытын анықтайды.
9.1 Қайтымды және қайтымсыз процестер
Егер жүйедегі термодинамикалық процесс тура және кері бағытта жүріп, бастапқы қалыпқа қайта оралғанда қоршаған ортада ешқандай өзгеріс болмаса, ондай процесті қайтымды деп атайды.
Кез-келген процесс қайтымды болу үшін ол тура бағытта жүрсе де, кері бағытта жүрсе де, барлық аралық күйлері тепе-теңдік болу керек. Егер процесс өте баяу жүрсе (газ баяу ұлғайғанда немесе сығылғанда), онда жүйенің осы процестің кез-келген уақытындағы күйін тепе-теңдік (квазастатикалық) деп, яғни, процесті қайтымды деп есептеуге болады. Іс жүзінде, кез-келген термодинамикалық процесс үйкеліс, жылуөткізгіштік, т.б. құбылыстармен қатар жүретіндіктен, жүйе энергиясының бір бөлігі (диссипацияланады) қоршаған сыртқы ортаға тарап кетеді. Сондықтан, нақты процестер әрқашан қайтымсыз болады.
 9.2 Дөңгелек процестер
9.2 Дөңгелек процестер
Жылулық қозғалтқыш (машиналар) депжылу энергиясын механикалық жұмысқа түрлендіретін құрылғыны айтады. Барлық жылулық машиналар (іштен жанатын қозғалтқыш, бу және газ турбиналары, т.б.) дөңгелек, яғни, циклдік режимде жұмыс істейді. Дөңгелек процесс (немесе, цикл) деп жүйенің бірнеше аралық күйлерден өтіп, бастапқы күйге қайта оралатын процестерін айтады. 9.1 – суреттте дөңгелек процесті p-V диаграммасындағы тұйықталған қисық арқылы бейнелеген.
 9.1 – сурет.Бір циклде жасалған жұмыс
9.1 – сурет.Бір циклде жасалған жұмыс
| Егер баллондағы газға  жылу мөлшерін берсе, онда ол жылу термодинамиканың бірінші бастамасы ( жылу мөлшерін берсе, онда ол жылу термодинамиканың бірінші бастамасы ( 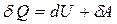 ) бойынша ішкі энергиясының өзгерісіне ( ) бойынша ішкі энергиясының өзгерісіне ( 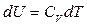 ) және газдың ұлғаюы кезінде жасалатын жұмысқа ( ) және газдың ұлғаюы кезінде жасалатын жұмысқа ( 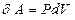 ) жұмсалады. Егер процесс изотермиялық ( ) жұмсалады. Егер процесс изотермиялық ( 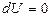 және және  ), онда берілген жылу толығымен газдың жасайтын жұмысына кетеді. Газдың көлемі ), онда берілген жылу толығымен газдың жасайтын жұмысына кетеді. Газдың көлемі  -ден -ден 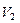 -ге дейін ұлғайғанда жасалған пайдалы оң -ге дейін ұлғайғанда жасалған пайдалы оң  жұмыс жұмыс 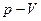 диаграммадағы диаграммадағы  қисықпен шектелген аймақтың ауданымен өлшенеді. Газды 1 күйге қайта оралту үшін оның көлемі қисықпен шектелген аймақтың ауданымен өлшенеді. Газды 1 күйге қайта оралту үшін оның көлемі 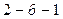 қисықпен бейнеленген процесс бойынша кішірейтіледі. қисықпен бейнеленген процесс бойынша кішірейтіледі.
|
Бұл процесс кезінде жасалған теріс жұмыс осы қисықтың астындағы аймақтың ауданымен анықталады. Егер газ көлемі ұлғайғанизотерматемпературасы Т1, оның сығылу изотермасының Т2 температурасынан үлкен болса ( 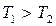 ), онда толық жұмыс
), онда толық жұмыс 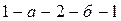 тұйықталған сызықпен шектелген аймақтың ауданына тең және оң болады. Олай болса, жылулық қозғалтқыш
тұйықталған сызықпен шектелген аймақтың ауданына тең және оң болады. Олай болса, жылулық қозғалтқыш 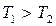 болғанда оң, ал T1<T2 болғанда теріс жұмыс жасайды. Кез-келген жылулық қозғалтқыштың жұмыс жасауы үшін қыздырғыш, суытқыш және жұмыс денесі қажет.
болғанда оң, ал T1<T2 болғанда теріс жұмыс жасайды. Кез-келген жылулық қозғалтқыштың жұмыс жасауы үшін қыздырғыш, суытқыш және жұмыс денесі қажет.
Дата добавления: 2022-01-22; просмотров: 39; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
