Релятивистік динамика элементтері 8 страница
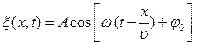 . (6.24)
. (6.24)
Мұндағы:  – толқын амплитудасы;
– толқын амплитудасы;  – толқынның фазасы;
– толқынның фазасы;  –циклдік жиілік;
–циклдік жиілік; 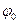 – тербелістің бастапқы фазасы. Бұл теңдеуге жылдамдық (
– тербелістің бастапқы фазасы. Бұл теңдеуге жылдамдық ( 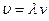 ) және циклдік жиілік (
) және циклдік жиілік ( 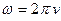 ) өрнектерін қойсақ келесі формуланы табамыз:
) өрнектерін қойсақ келесі формуланы табамыз:
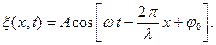 (6.25)
(6.25)
Егер толқындық сан ұғымын енгізсек ( 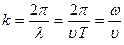 ), онда жазық қума толқын теңдеуін келесі түрде жазуға болады:
), онда жазық қума толқын теңдеуін келесі түрде жазуға болады:
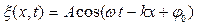 . (6.26)
. (6.26)
6.7 Тұрғын толқындар
Қарама-қарсы бағытта таралған, жиіліктері мен амплитудалары бірдей екі жазық толқын:
 және
және 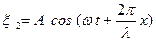 , (6.27)
, (6.27)
беттессе, онда олардың қосылуы (интерференциясы) нәтижесінде тұрғын толқын пайда болады:
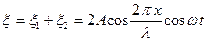 . (6.28)
. (6.28)
Тұрғын толқын амплитудасы
 (6.29)
(6.29)
уақытқа тәуелсіз, х кординатасының периодты функциясы болады.
Қума және тұрғын жазық толқындардың сипаттамалары 6.1 – кестеде берілген.
6.1–кесте
Қума толқын
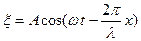
| Тұрғын толқын
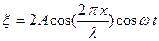
| ||
| Тербеліс амплитудасы | |||
Орта нүктелерінің тербеліс амплитудалары  бірдей бірдей
| Орта нүктелерінің тербеліс амплитудалары әртүрлі 
| ||
| Тербеліс фазасы | |||
Тербеліс фазасы  қарастырылып отырған нүктенің қарастырылып отырған нүктенің  координатасына тәуелді координатасына тәуелді
| Екі түйіннің арасындағы барлық нүктелер бірдей фазада тербеледі. Түйін арқылы өткенде тербеліс фазасы 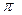 -ге өзгереді. -ге өзгереді.
| ||
| Энергия тасымалдануы
| |||
| Тербелмелі қозғалыс энергиясы толқынның таралу бағытында тасымалданады. | Энергия тасымалданбайды,  шегінде энергияның өзара түрлену процесі жүреді шегінде энергияның өзара түрлену процесі жүреді
| ||
Ортаның 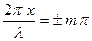
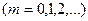 болатын нүктелерінде толқын амплитудасы максимум болады (
болатын нүктелерінде толқын амплитудасы максимум болады ( 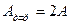 ). Мұндай нүктелер тұрғын толқынның шоғырлары деп аталады. Ортаның
). Мұндай нүктелер тұрғын толқынның шоғырлары деп аталады. Ортаның 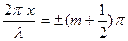
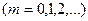 болатын нүктелерінде толқын амплитудасы нөлге айналады (
болатын нүктелерінде толқын амплитудасы нөлге айналады ( 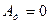 ). Мұндай нүктелер тұрғынның толқын түйіндері деп аталады.
). Мұндай нүктелер тұрғынның толқын түйіндері деп аталады.
Шоғырлар мен түйіндердің координаталары
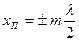 және
және 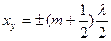 . (6.30)
. (6.30)
Көршілес екі түйіннің немесе шоғырдың ара қашықтығы қума толқын ұзындығының жартысына тең. Бұл шама, 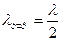 , тұрғын толқын ұзындығы деп аталады.
, тұрғын толқын ұзындығы деп аталады.
Әдебиеттер:
Негізгі: 1[176-235], [298-333], 3 [86-114]
Қосымша: 12[219-254]
Бақылау сұрақтары:
1. Гармониялық тербеліске, оның амплитудасына, фазасына, периодына, циклдік жиілігіне анықтама беріңіз.
2. Гармониялық тербелістегі нүктенің жылдамдығы мен үдеуінің формуласын қорытып шығарыңыз.
|
|
|
3. Маятниктердің қандай түрлері сізге белгілі? Олардың ерекшеліктері қандай?
4. Гармониялық тербелістегі нүктенің кинетикалық, потенциалдық және толық энергияларының формуласын қорытып шығарыңыз және оны түсіндіріңіз.
7-дәріс (6 -лекция болуы тиіс )
II бөлім . Молекулалық физика және термодинамика
Молекулалық физика денелердің әртүрлі агрегаттық күйлердегі физикалық қасиеттерін заттардың микроскопиялық құрылысы негізінде зерттейтін физика бөлімі. Заттардың қасиеттері молекула-кинетикалық теория тұрғысынан статистикалық әдіс арқылы зерттеледі.
Термодинамикада тепе-теңдіктегі макроскопиялық жүйелердің жалпы қасиеттері мен олардың бір термодинамикалық күйден екінші күйге ауысу процестері зерттеледі. Термодинамика көптеген тәжірибе нәтижелерін қорытындылау арқылы анықталған, жүйедегі денелер табиғатына тәуелсіз орындалатын бірнеше бастама негізінде құрылған. Молекула-кинетикалық теория мен термодинамика бір-бірін толықтырып, біртұтас ілім құрайды.
|
|
|
Өте көп бөлшектерден тұратын жүйелер бірін-бірі толықтыратын екі әдіс арқылы тағайындалған: статистикалық және термодинамикалық.
Статистикалық әдісте белгілі бір зерттелетін жүйенің нұсқауларының құрылысы мен ықтималдық теориясы қолданылады. Өте көп бөлшектердің координаттары мен импульстері кез-келген уақыт мезетінде кездейсоқ шамаларға ие болады, бұл жағдайда статистикалық заңдылықтар тағайындалады.
Физикалық құбылыстарды зерттеуде қолданылатын екінші әдіс термодинамикалық (жылулық қозғалыс) деп аталады. Бұл әдісте денелердің ішкі құрылысы және оны құраушы бөлшектердің қозғалыс сипаттамалары қарастырылмайды.
7 Термодинамикалық жүйелер мен олардың параметрлері
Термодинамикалық жүйе деп бір-бірімен және сыртқы денелермен зат пен энергия алмасушы дараланған макроскопиялық денелер жүйесін айтады.
7.1 Термодинамикалық параметрлер мен процестер
Жүйенің күйін сипаттау үшін жүйенің т ермодинамикалық параметрлері (күй параметрлері) деп аталатын физикалық шамалар енгізілген. Оларға р – қысым, 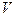 – көлем, Т – температура, п – концентрация және т.б. жатады.
– көлем, Т – температура, п – концентрация және т.б. жатады.
|
|
|
Қысым р – дененің бірлік бетіне нормаль бойымен әсер ететін күшке тең шама 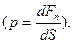 Өлшем бірлігі – Па (Паскаль) (
Өлшем бірлігі – Па (Паскаль) ( 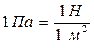 ).
).
Жүйенің температурасы – оның бөлшектерінің жылулық қозғалыс қарқынының өлшемі. Физикада бірнеше температуралық шкала қолданылады. Мысалы, Кельвин ( 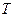 ) және Цельсий (
) және Цельсий ( 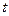 ) шкалаларындағы температуралар өзара
) шкалаларындағы температуралар өзара
T = t + 273,15 (7.1)
өрнегімен байланысқан.
Қалыпты күйде термодинамикалық параметрлер келесі мәндерге тең болады:
p=1,013· 105 Па, VM=22,4· 10-3 м 3 , T=273,15K . (7.2)
Термодинамикалық процесс деп жүйенің кез-келген параметрінің өзгерісін айтады.
7.2 Идеал газдың күй теңдеуі
Идеал газ деп бір-бірімен әсерлесу күштері ескерілмейтін, өзара және ыдыс қабырғасымен соқтығысулары абсолют серпімді болатын ретсіз қозғалыстағы материалдық нүктелер жүйесін айтады.
Идеал газдың күй теңдеуі – термодинамикалық параметрлер арасындағы функционалдық байланыс: 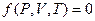 . Көптеген тәжірибе нәтижелерін қорыта отырып, Менделеев (1874), бір моль идеал газ үшін келесі теңдеуді анықтады:
. Көптеген тәжірибе нәтижелерін қорыта отырып, Менделеев (1874), бір моль идеал газ үшін келесі теңдеуді анықтады:
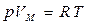 . (7.3)
. (7.3)
Мұндағы 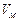 – газдың молярлық көлемі;
– газдың молярлық көлемі;  – универсал газ тұрақтысы
– универсал газ тұрақтысы 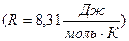 . Массасы
. Массасы  , көлемі
, көлемі  и деал газдың күй теңдеуі:
и деал газдың күй теңдеуі:
 . (7.4)
. (7.4)
Бұл Менделеев – Клапейрон теңдеуі. Клайперон теңдеуін тағы бір түрде жазуға болады: 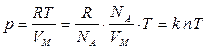 немесе
немесе
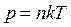 . (7.5)
. (7.5)
Мұндағы:  – мөлшері 1 моль заттағы молекулалар санына тең Авогадро саны,
– мөлшері 1 моль заттағы молекулалар санына тең Авогадро саны,  – Больцман тұрақтысы,
– Больцман тұрақтысы,  – молекулалар концентрациясы (бірлік көлемдегі газ бөлшектерінің саны). Тұрақты температурада газ қысымы молекулалардың концентрациясына пропорционал болады.
– молекулалар концентрациясы (бірлік көлемдегі газ бөлшектерінің саны). Тұрақты температурада газ қысымы молекулалардың концентрациясына пропорционал болады.
7.3 Идеал газдардың молекула-кинетикалық теориясы
Идеал газ үшін молекула-кинетикалық теорияның негізгі теңдеуі
Үздіксіз бейберекет ретсіз қозғалыстағы газ молекулаларының өзара және ыдыс қабырғасымен соқтығысуы абсолют серпімді болады. Молекулалардың соқтығысулары арқылы олардың арасында жылдамдық пен энергия алмасулары жүреді. Молекулалардың қабырғамен соқтығысуынан газ қысымы пайда болады.
Идеал газ үшін молекула-кинетикалық теорияның негізгі теңдеуі жүйенің тәжірибеде өлшенетін р макроскопиялық параметрі мен бөлшектің микроскопиялық параметрін байланыстырады ( 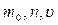 ):
):
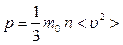 , (7.6)
, (7.6)
мұндағы 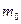 –молекула массы, п –молекулалар концентрациясы;
–молекула массы, п –молекулалар концентрациясы;  – газ молекулаларының ілгерілемелі қозғалысының орташа квадраттық жылдамдығы (көп жағдайда
– газ молекулаларының ілгерілемелі қозғалысының орташа квадраттық жылдамдығы (көп жағдайда  түрінде белгіленеді).
түрінде белгіленеді).
7.4 Газ молекулаларының ілгерілемелі қозғалысының
орташакинетикалық энергиясы
Идеал газдың молекула-кинетикалық теориясының негізгі теңдеуін (7.6) келесі түрде жазуға болады:
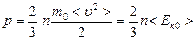 . (7.7)
. (7.7)
Қысым бірлік көлемдегі молекулалардың ілгерілемелі қозғалысының орташа кинетикалық энергиясының 2/3 -не тең болады. Олай болса, қысым күштік сипаттама ғана емес, энергетикалық сипаттама да болып та табылады.
Жоғарыдағы (7.6), (7.7) және (7.3) өрнектерден келесі шамаларды келтіріп шығаруға болады:
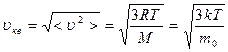 . (7.8)
. (7.8)
Бұдан идеал газдың бір молекуласының орташа кинетикалық энергиясы тек Т термодинамикалық температураға ғана тәуелді екенін көреміз:
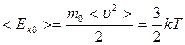 . (7.9)
. (7.9)
Соңғы өрнек идеал газ молекуласының термодинамикалық орташа кинетикалық энергиясы ( 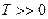 К) температураға пропорционал болатынын көрсетеді.
К) температураға пропорционал болатынын көрсетеді.
7.5 Статистикалық таралу
Молекулалық физикада зерттелетін құбылыстар өте көп бөлшектердің біріккен әсерінің нәтижесі. Өте көп бөлшектер жүйесі статистикалық заңдылықтарға бағынатындықтан, оларды зерттеуге статистикалық әдіс қолданылады.
7.5.1 Энергияның еркіндік дәрежелер бойынша бірқалыпты таралу заңы
Дененің еркіндік дәрежесі (і) деп оның кеңістіктегі орнын толық анықтауға қажет тәуелсіз координаталардың ең аз санын айтады.
Идеал газдың қатаң байланысқан молекулалары үшін і мәні 7.1-кестеде берілген.
7.1–кесте
| Еркіндік дәрежесінің саны | Біратомды газ | Екіатомды газ | Көпатомды газ |
| Ілгерілемелі | 3 | 3 | 3 |
| Айналмалы | 0 | 2 | 3 |
| Барлығы | 3 | 5 | 6 |
Кестеден молекула үшін ілгерілемелі қозғалыстың еркіндік дәрежесі әрқашан үшке тең болатынын көреміз. Ілгерілемелі қозғалыстың әр еркіндік дәрежесіне бір атомды молекуланың орташа кинетикалық энергиясының үштен біріне (1/3) сәйкес келеді:
 . (7.10)
. (7.10)
Дата добавления: 2022-01-22; просмотров: 44; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
