Релятивистік динамика элементтері 10 страница
8-дәріс
Термодинамикның бірінші бастамасы
Термодинамикада макраскопиялық денелердің жылулық қасиеттері олардың микроскопиялық табиғатымен байланыстырылмай, көптеген тәжірибелер арқылы анықталған, бастамалар деп аталтын негізгі үш заңға сүйеніп зерттеледі. Термодинамиканың бірінші бастамасы энергияның сақталу және түрлену заңдарын сипаттайды.
8.1 Жүйенің ішкі энергиясы
Ішкі энергия жүйедегі барлық микробөлшектердің – атомдар мен молекулалардың қозғалыс энергияларынан және олардың өзара әсерлесу энергияларынан құралады. 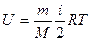 өрнектен идеал газдың ішкі энергиясы тек температураға тәуелді екендігі, яғни, ол жүйенің бірмәнді күй функциясы болатынын көреміз. Кез-келген жүйенің ішкі энергиясының мәні оның бұл күйге қалай келгеніне тәуелді болмайды. Басқаша айтқанда, жүйе 1 күйден 2 күйге өткенде оның ішкі энергиясының өзгерісі оның соңғы және бастапқы энергияларының айырымына тең. Сондықтан, жүйе қандай-да бір процестерден соң бастапқы күйге қайта оралса, онда ішкі энергияның өзгерісі нольге тең болады:
өрнектен идеал газдың ішкі энергиясы тек температураға тәуелді екендігі, яғни, ол жүйенің бірмәнді күй функциясы болатынын көреміз. Кез-келген жүйенің ішкі энергиясының мәні оның бұл күйге қалай келгеніне тәуелді болмайды. Басқаша айтқанда, жүйе 1 күйден 2 күйге өткенде оның ішкі энергиясының өзгерісі оның соңғы және бастапқы энергияларының айырымына тең. Сондықтан, жүйе қандай-да бір процестерден соң бастапқы күйге қайта оралса, онда ішкі энергияның өзгерісі нольге тең болады:  . Олай болса, ішкі энергияның элементар өзгерісі толық дифференциал болып табылады.
. Олай болса, ішкі энергияның элементар өзгерісі толық дифференциал болып табылады.
8.2 Жұмыс және жылу
|
|
|
Тұйық термодинамикалық жүйе сыртқы денелермен екі түрлі әдіспен: жұмыс жасау және жылу алмасу арқылы энергия алмаса алады. Бірінші әдіс бойынша денелер өзара күштік әсерлесу арқылы энергия алмасады. Жұмыс жасау кезінде энергия жүйеге берілсе, онда жұмыс жүйені өзгертуге жасалды дейді. Ауданы S қозғалмалы поршені бар ыдыс ішіндегі газ ұлғайғандағы және сығылғандағы жасалатын жұмысты қарастырайық (8.1 – cурет). Сыртқы қысым 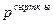 болса, онда поршенге әсер етуші күш:
болса, онда поршенге әсер етуші күш: 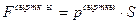 . Поршень
. Поршень  аз шамаға орын ауыстырғанда, газ ол күшке қарсы
аз шамаға орын ауыстырғанда, газ ол күшке қарсы  жұмыс
жұмыс
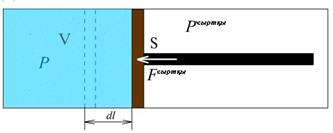 8.1- сурет. Поршенді ыдыстығы газдың жұмысы
8.1- сурет. Поршенді ыдыстығы газдың жұмысы
| жасайды: Поршень  аз шамаға орын ауыстырғанда, газ ол күшке қарсы аз шамаға орын ауыстырғанда, газ ол күшке қарсы  жұмыс жасайды: жұмыс жасайды:
 мұндағы мұндағы 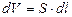 –газ көлемінің өзгерісі. Егер газ көлемі квазистатикалық түрде өзгерсе, –газ көлемінің өзгерісі. Егер газ көлемі квазистатикалық түрде өзгерсе,
|
онда жүйе кез-келген уақытта сыртқы ортамен 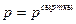 қысыммен тепе-теңдікте болады. Тепе-теңдік процесс кезінде газдың көлемі өзгергенде жасалатын элементар жұмыс
қысыммен тепе-теңдікте болады. Тепе-теңдік процесс кезінде газдың көлемі өзгергенде жасалатын элементар жұмыс
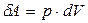 (8.1)
(8.1)
|
|
|
болады.
Газдың қысымы әрқашан оң ( 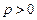 ). Сондықтан, ұлғаю кезінде (
). Сондықтан, ұлғаю кезінде ( 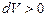 ) газ оң жұмыс жасайды (
) газ оң жұмыс жасайды ( 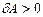 ), ал сығылу кезінде (
), ал сығылу кезінде ( 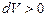 ) газ теріс жұмыс жасайды (
) газ теріс жұмыс жасайды ( 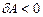 ). Сыртқы денелерден жүйеге энергияның жылуалмасу арқылы берілуі жылу деп аталады. Жылуалмасу әртүрлі температурадағы денелер арасында немесе бір дененің бөлшектері арасында жүреді.Жылуалмасу конвективтік, жылуөткізгіштік, сәулелік болып үшке бөлінеді. Конвективтік жылуалмасу – температурасы әртүрлі газ, сұйықтық, қатты денелер қозғалысы арқылы немесе газ бен сұйықтықтың температурасы әртүрлі бөліктерінің қозғалысы арқылы жүреді. Жылуалмасу – дененің әртүрлі дәрежеде қызған бөліктері арасында жүреді. Сәулелік жылуалмасу (радиациалық жылуалмасу) денелердің бір-бірімен тікелей түйісусіз, тек электрмагниттік энергия шығару немесе жұту арқылы жүреді.
). Сыртқы денелерден жүйеге энергияның жылуалмасу арқылы берілуі жылу деп аталады. Жылуалмасу әртүрлі температурадағы денелер арасында немесе бір дененің бөлшектері арасында жүреді.Жылуалмасу конвективтік, жылуөткізгіштік, сәулелік болып үшке бөлінеді. Конвективтік жылуалмасу – температурасы әртүрлі газ, сұйықтық, қатты денелер қозғалысы арқылы немесе газ бен сұйықтықтың температурасы әртүрлі бөліктерінің қозғалысы арқылы жүреді. Жылуалмасу – дененің әртүрлі дәрежеде қызған бөліктері арасында жүреді. Сәулелік жылуалмасу (радиациалық жылуалмасу) денелердің бір-бірімен тікелей түйісусіз, тек электрмагниттік энергия шығару немесе жұту арқылы жүреді.
Жылуалмасу мен жұмыстың ішкі энергиядан ерекшелігі, олар жүйе күйінемес жүйе күйінің өзгерісін сипаттайды. Олар жүйе күйі өзгерісінің энергетикалық сипаттамасы болғандықтан, жылуалмасу мен жұмыстың мәндері процесс түріне тәуелді болады. Жылу мен жұмыс жүйенің энергия түріне жатпайды. Дененің жылу немесе жұмыс қоры деген түсінік жоқ. Сондықтан 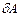 мен
мен 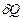 күй функциясы емес, процесс функциясы.
күй функциясы емес, процесс функциясы.
|
|
|
8 Термодинамиканың бірінші заңы
Жүйеге берілген жылу мөлшері оның ішкі энергиясының өзгерісі мен жүйенің сыртқы күштерге қарсы жасайтын жұмысына жұмсалады:
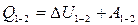 . (8.2)
. (8.2)
Бұл термодинамикалық жүйе үшін энергияның сақталу және түрлену заңы. Жылу энергиясы тек ішкі энергия мен жұмысқа ғана түрленуі мүмкін: ішкі энергия – энергияның микроскопиялық, ал жұмыс – макроскопиялық түрі.
Жүйеге берілген жылудың  аз мөлшерінің жүйе жасайтын
аз мөлшерінің жүйе жасайтын 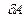 элементар жұмыс пен
элементар жұмыс пен 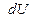 ішкі энергияның аз өзгерісіне жұмсалатынын сипаттайтын бұл заңды әдетте мына түрде жазады:
ішкі энергияның аз өзгерісіне жұмсалатынын сипаттайтын бұл заңды әдетте мына түрде жазады:
 . (8.3)
. (8.3)
Жылу  мен жұмыс
мен жұмыс 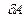 және ішкі энергия өзгерісі
және ішкі энергия өзгерісі 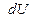 жазылулары арасындағы өзгешеліктің, жоғарыда айтылғандай, терең физикалық мағынасы бар.
жазылулары арасындағы өзгешеліктің, жоғарыда айтылғандай, терең физикалық мағынасы бар.
|
|
|
Термодинамиканың бірінші заңына енетін барлық шамалар оң, теріс немесе нөл болуы мүмкін. Егер жүйеге жылу берілсе 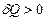 , алынса
, алынса 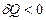 .
.
Егер жүйе, мысалы жұмыс денесі, периодты жұмыс істейтін қозғалтқыш ішінде 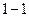 процесс бойынша бастапқы күйге қайта оралып отырса, онда
процесс бойынша бастапқы күйге қайта оралып отырса, онда 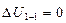 ал осыдан
ал осыдан 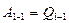 . Олай болса, ешқандай периодты жұмыс істейтін қозғалтқыш оған берілген энергиядан артық жұмыс жасай алмайды. Бірінші текті мәңгі қозғалтқыш жасау мүмкін еместігін дәлелдейтін бұл тұжырымдама термодинамиканың бірінші заңы деп аталады.
. Олай болса, ешқандай периодты жұмыс істейтін қозғалтқыш оған берілген энергиядан артық жұмыс жасай алмайды. Бірінші текті мәңгі қозғалтқыш жасау мүмкін еместігін дәлелдейтін бұл тұжырымдама термодинамиканың бірінші заңы деп аталады.
8.4 Термодинамикалық процестер мен жұмыстың графиктері
Тепе-теңдіктегі термодинамикалық процестерді бір-бірімен олардың графиктері арқылы салыстырып зерттеген ыңғайлы. Ол үшін 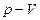 ,
, 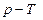 және
және  диаграммаларын салу керек.
диаграммаларын салу керек. 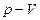 диаграммасы салынған 8.2 –
диаграммасы салынған 8.2 –
суреттегі 1 және 2 нүктелер бастапқы және соңғы күйлерді сипатайды. Термодинамикалық процесс 1 - 2 қисығымен көрсетілген. Элементар жұмыс 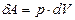 суретте боялған жолақпен анықталады. Жүйенің 1 – 2 процесс кезінде жасаған жұмысы осы қисық астындағы фигураның ауданына тең: суретте боялған жолақпен анықталады. Жүйенің 1 – 2 процесс кезінде жасаған жұмысы осы қисық астындағы фигураның ауданына тең:
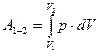 .
Суреттен .
Суреттен 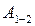 жұмысының мөлшері жүйенің бастапқы күйден соңғы күйге қалай өткеніне, яғни, процеске байланысты екені көрініп тұр. жұмысының мөлшері жүйенің бастапқы күйден соңғы күйге қалай өткеніне, яғни, процеске байланысты екені көрініп тұр.
|
8.2 - сурет. Изотермиялық процесс кезіндегі газдың жұмысы | ||
|
| |||
8.5 Заттың жылусыйымдылығы
Заттың жылулық қасиеттерін сипаттайтын негізгі параметрлердің бірі оның жылусыйымдылығы. Заттың жылусыйымдылығы 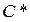 – дененің температурасын 1K-ге өзгертуге қажет
– дененің температурасын 1K-ге өзгертуге қажет 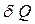 жылу мөлшеріне тең физикалық шама:
жылу мөлшеріне тең физикалық шама:
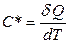 . (8.4)
. (8.4)
Заттың жылусыйымдылығы оның массасына, химиялық құрамына, термодинамикалық күйіне және оған  жылу беру процесіне тәуелді. Жылусыйымдылық меншікті(
жылу беру процесіне тәуелді. Жылусыйымдылық меншікті( 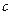 ) (бірлік массаның жылусыйымдылығы) және мольдік (
) (бірлік массаның жылусыйымдылығы) және мольдік (  ) (1 моль заттың жылусыйымдылығы) болып ажыратылады:
) (1 моль заттың жылусыйымдылығы) болып ажыратылады:
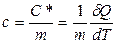 және
және 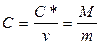
 , (8.5)
, (8.5)
мұндағы: 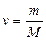 – зат мөлшері;
– зат мөлшері; 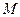 – затың мольдік массасы.
– затың мольдік массасы.
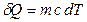
 (8.6)
(8.6)
Меншікті және мольдік жылусыйымдылықтардың өлшем бірліктері – 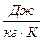 және
және 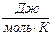 . Газдардың жылусыйымдылығы тұрақты көлемдегі
. Газдардың жылусыйымдылығы тұрақты көлемдегі  және тұрақты қысымдағы
және тұрақты қысымдағы 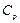 жылусыйымдылықтар болып бөлінеді.
жылусыйымдылықтар болып бөлінеді.
8.6 Термодинамиканың бірінші бастамасын идеал
газдардағы изопроцестерге қолдану
Идеал газдың тепетеңдіктегі күйінің өзгерісі үшін термодинамиканың бірінші бастамасын 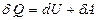 мына түрде жазуға болады:
мына түрде жазуға болады:
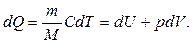 (8.7)
(8.7)
Осы теңдеуді идеал газдардағы изопроцестерге қолданайық. Изопроцесс заңдарын Менделеев-Клапейрона  теңдеуінен анықтаймыз.
теңдеуінен анықтаймыз.
8.6.1 Изохоралық процесс ( 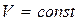 )
)
Изохоралық процесс деп газды қыздыру немесе суыту процестері тұрақты көлемде өтетін процестерді айтады. Мұндай процестер үшін идеал газ күйінің теңдеуін келесі түрде жазған ыңғайлы:  . Теңдіктің оң жағындағы шамалардың барлығы тұрақты. Сондықтан, газдың массасы мен көлемі тұрақты болса, онда оның қысымы температураға пропорционал болады:
. Теңдіктің оң жағындағы шамалардың барлығы тұрақты. Сондықтан, газдың массасы мен көлемі тұрақты болса, онда оның қысымы температураға пропорционал болады:
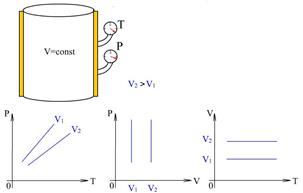 8.3 - сурет. Газ көлемінің
8.3 - сурет. Газ көлемінің  әртүрлі мәндері үшін изохоралық процестер диаграммалары. әртүрлі мәндері үшін изохоралық процестер диаграммалары.
| 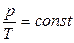 . (8.8)
8.3–суретте газ көлемінің . (8.8)
8.3–суретте газ көлемінің  әртүрлі мәндеріндегі изохоралық процестердің p~T, p~V және V~T диаграммалары көрсетілген. Бұл процестерде газдың көлемі өзгермейтіндіктен (dV=0) газ жұмыс жасамайды ( әртүрлі мәндеріндегі изохоралық процестердің p~T, p~V және V~T диаграммалары көрсетілген. Бұл процестерде газдың көлемі өзгермейтіндіктен (dV=0) газ жұмыс жасамайды ( 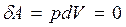 ), денеге берілген барлық жылу ), денеге берілген барлық жылу
|
энергиясы оның ішкі энергиясының өзгеруіне жұмсалады. Термодинамиканың бірінші бастамасы мына түрде болады:
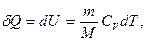 (8.9)
(8.9)
мұндағы  – газдың тұрақты көлемдегі мольдік жылусыйымдылығы.
– газдың тұрақты көлемдегі мольдік жылусыйымдылығы.
Газдың температурасын Т1–ден Т2–ге дейінизохоралық түрде қыздырғанда, оның ішкі энергиясының өзгерісі берілген жылу мөлшеріне тең болады:
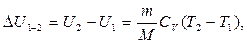
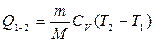 . (8.10)
. (8.10)
Кез-келген тепе-теңдіктегі процесс үшін термодинамиканың бірінші заңын келесі түрде жазуға болады:
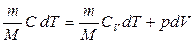 . (8.11)
. (8.11)
Бір моль газ үшін
 . (8.12)
. (8.12)
8.6.2 Изобаралық процесс ( 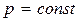 )
)
Изобаралық процесс деп газды қыздыру немесе суыту процестері тұрақты қысымда өтетін процестерді айтады. Мұндай процесс үшін идеал газдың күй теңдеуін оң жағында тек тұрақты шамалар қалатын 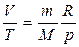 түрінде жазған ыңғайлы. Бұл теңдеуден изобаралық процесс үшін келесі тұжырымдама жасауға болады: газдың берілген массасы үшін тұрақты қысымда көлем температураға пропорционал өзгереді:
түрінде жазған ыңғайлы. Бұл теңдеуден изобаралық процесс үшін келесі тұжырымдама жасауға болады: газдың берілген массасы үшін тұрақты қысымда көлем температураға пропорционал өзгереді:
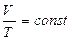 . (8.13)
. (8.13)
Дата добавления: 2022-01-22; просмотров: 41; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

