Дифтерия, характеристика возбудителя. Микробиологическая диагностика, лечение, профилактика.
Дифтерия – острое антропонозное заболевание, вызываемое токсигенными штаммами Corynebacterium diphtheriae, передающееся воздушно-капельным путем, характеризующееся развитием местного фибринозного воспаления, а также интоксикацией, поражением преимущественно сердечно-сосудистой и нервной систем.
Морфологические и тинкториальные свойства.
Тонкие грамположительные неподвижные палочки, спор и капсул не образуют, утолщены на концах за счёт зёрен волютина, которые выявляют по реакции метахромазии в реакции Нейссера или с толуидиновым синим.
Для коринебактерий характерен выраженный полиморфизм. В мазках они могут располагаться в виде буквы X, Y, V.
Культуральные свойства.
Факультативный анаэроб, оптимум роста – 37 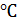 . Дифференциально-диагностический средой является кровяной теллуритовый агар (среда Клауберга), на которых образуются колонии чёрного цвета. Элективной средой для накопления чистой культуры является среда Ру-Леффлера (кровяная сыворотка + сахарный бульон). На этой среде образуются характерные желтовато-кремовые колонии.
. Дифференциально-диагностический средой является кровяной теллуритовый агар (среда Клауберга), на которых образуются колонии чёрного цвета. Элективной средой для накопления чистой культуры является среда Ру-Леффлера (кровяная сыворотка + сахарный бульон). На этой среде образуются характерные желтовато-кремовые колонии.
Биохимические свойства.
Для всех штаммов C. diphtheriae характерно расщепление глюкозы с образованием кислоты.
Отличительным признаком дифтерийной палочки является отрицательная проба Закса (не способность расщеплять мочевину).
Другое важное свойство – продукция фермента цистиназы, которая расщепляет цистеин с образованием сероводорода, образующего чёрный осадок с уксуснокислым свинцом (положительная проба Пизу).
По культурально-биохимическим свойствам вид C. diphtheriae делят на 3 биовара: gravis , mitis , intermedius.
Тяжёлый и промежуточный биовары формируют на питательных средах крупные шероховатые матовые колонии с неровными краями (R-колонии), расщепляют крахмал.
Лёгкий биовар формирует на питательных средах мелкие гладкие блестящие чёрные колонии с ровными краями (S-колонии), не расщепляет крахмал.
Антигены.
Имеется видовой O-антиген, а также вариантспецифический K-антиген.
Антигенная структура неоднородна, изменчива, что обуславливает слабую напряжённость антибактериального иммунитета!
Факторы патогенности.
Основными являются следующие:
1. Ферменты агрессии и защиты:
- гиалуронидаза (играет ключевую роль в повышении проницаемости сосудистой стенки);
- нейраминидаза и N-ацетилнейрамиатлиаза, которые действуют эстафетно, то есть нейраминидаза отщепляет остатки сиаловых кислот от ганглиозидов, что определяет фиксацию гистотоксина, а N-ацетилнейрамиатлиаза отщепляет пируват от N-ацетилнейраминовой кислоты, и пируват является источником энергии для размножающихся клеток;
- дермонекротоксин – опосредует некроз тканей в месте локализации возбудителя.
2. Экзотоксин
Основной фактор патогенности – продукция экзотоксина, который иначе называют гистотоксином.
Токсин состоит из двух фрагментов: A и B. Фрагмент B связывается с рецепторами клеток, а самое токсическое действие проявляет фрагмент А, которая обладает АДФ-рибозилтрансферазной активностью, инактивируя при этом один из факторов элонгации – EF-2. Нарушение синтеза белка приводит к гибели клеток.
Однако мощное токсическое действие оказывается и на ЦНС, а также сердечно-сосудистую систему. По наиболее популярной версии гистотоксин способствует развитию жировой дистрофии миокарда, поскольку нарушает челночный механизм транспорта жирных кислот в митохондрии.
Способность продуцировать экзотоксин определяется tox-геном, наличие которого связано с лизогенной конверсией.
Эпидемиология.
Источник инфекции – больные и носители токсигенных штаммов. Путь передачи – воздушно-капельный.
Патогенез.
Наиболее часто входными воротами является слизистая ротоглотки. Гораздо реже в патологический процесс вовлекаются слизистая гортани, повреждённые кожные покровы, слизистая глаз, половых органов.
Размножаясь в месте входных ворот, дифтерийные палочки усиленно продуцируют токсин, который поступает в кровь.
В области входных ворот развивается воспалительная реакция: некроз клеток, повышение проницаемости сосудистой стенки, выход фибриногена, который превращается в фибрин за счёт тромбопластина некротизированных клеток. При этом образуется сероватая плёнка, плотно спаянная с подлежащими тканями.
Клиническая картина.
Инкубационный период 2-10 дней.
Все проявления дифтерии можно разделить на местные и генерализованные.
Местные проявления – формирование плёнки в области зева. Данная плёнка с трудом отделяется от подлежащих тканей, и попытка её отделить приводит к формированию кровоточащих язв. Воспалительная реакция приводит к болезненным ощущениям в горле, а если плёнок становится чрезвычайно много, они накладываются друг на друга, закрывая доступ воздуху, и может наступить асфиксия.
Генерализованные проявления – это, по существу, токсинемия. Возникает лихорадка, выраженная слабость, кахексия. Поражение ЦНС приводит к спутанности сознания, нарушении в координации. Поражение сердца (миокардиты, дистрофия) приводят к болям, одышке, сердечной недостаточности.
Иммунитет.
После перенесённого заболевания формируется длительный и напряжённый антитоксический иммунитет. В отличие от него, антибактериальный иммунитет ненапряжённый (см. выше).
Микробиологическая диагностика.
Материал для исследования:
1. Кусочки дифтерийной плёнки;
2. Носоглоточная слизь
Сбор материала осуществляют не позже 3-4 с момента обращения больного. Его осуществляют ватным тампоном, но если материал транспортируется на дальние расстояния, то можно смочить вату в 5% растворе глицерина.
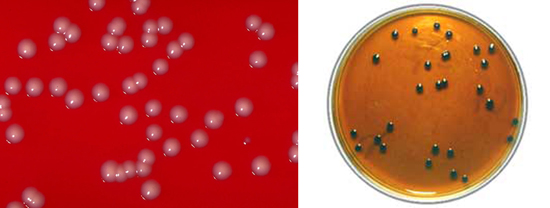
Посев материала осуществляют на среду Клауберга (восстановление теллурита калия определяет чёрный цвет колоний). Учёт роста на этих средах позволяет судить о том или ином биоваре:
- крупные чёрные колонии с неровными краями в виде розеток – биовар gravis;
- мелкие блестящие чёрные колонии с ровными краями – биовар mitis
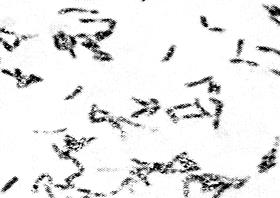
Часть колонии пересевают на агар для накопления, после чего традиционно осуществляется микроскопия мазка, наиболее часто используется окраска по Нейссеру (см. выше).
Далее идентификацию токсигенных штаммов осуществляют в следующих направлениях:
- определение токсигенности;
- определение цистиназы;
- проба Закса;
- изучение комплекса прочих биохимических свойств
Определение токсигенности чаще всего осуществляют реакцией преципитации в геле («чашечный метод»). Для этого в чашку Петри с питательной средой кладут полоску фильтровальной бумаги, пропитанной антитоксической сывороткой. После чего её засевают штрихами исследуемые культуры перпендикулярно полоске. Далее инкубируют при 37 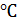 в течение 18-20 часов. Положительный результат – образование «усов преципитации».
в течение 18-20 часов. Положительный результат – образование «усов преципитации».
Ускоренно можно определить токсин в крови или культуре с помощью РПГА и ИФА.
Цистиназу определяют по почернению из-за образования сульфида свинца.
Очень важно отдифференцировать дифтерийную палочку от непатогенных коринебактерий, причём наиболее показательной для этого является отрицательная проба Закса (отсутствие расщепления мочевины, поэтому раствор мочевины и фенолового красного не меняет окраски при внесении туда культуры).
С помощью РПГА можно оценивать степень напряжённости антитоксического иммунитета в различных коллективах (например, школы).
ПЦР можно применять для обнаружения tox-гена.
Лечение.
Антитоксическая сыворотка с одновременным использованием этиотропной антибиотикотерапии.
Профилактика.
Специфическая профилактика осуществляется:
- введением АКДС;
- введением АДС-анатоксина;
- АДС-М-анатоксин (адсорбированный дифтерийно-столбнячный анатоксин с уменьшенным содержанием антигенов);
- французский аналог АДС-М-анатоксин Имовакс Д.Т. Адюльт.
Дата добавления: 2019-09-13; просмотров: 397; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
