Опыт 4. Окисление иодид-ионов перманганат-ионами в кислой среде
К 5-6 каплям раствора иодида калия добавьте 5-6 капель разбавленного раствора серной кислоты и 2-3 капли раствора перманганата калия до исчезновения фиолетовой окраски перманганата и появления желтой окраски йода.
Реакция протекает по схеме:
KI + KMnO4 + H2SO4 -> I2 + MnSO4 + K2SO4 + H2O
Задание:К данной схеме реакции подберите коэффициенты методом электронного баланса.
Опыт 5. Окислительные свойства дихромат-ионов
а) окисление нитрит-ионов дихромат-ионами в кислой среде
К 2-3 каплям раствора дихромата калия добавьте 3-4 капли разбавленного раствора серной кислоты и 4-5 капель раствора нитрита натрия. Смесь осторожно нагрейте до перехода оранжевой окраски дихромат-ионов в изумрудно-зеленую окраску ионов Cr :
NaNO2 + K2Cr2O7 + H2SO4 -> NaNO3 +Cr2(SO4)3 + K2SO4 + H2O
Задание: Подберите коэффициенты к данной схеме реакции методом электронного баланса.
б)окисление сульфит-ионов дихромат-ионами в кислой среде
К 2-3 каплям раствора дихромата калия добавьте 3-4 капли разбавленного раствора серной кислоты и несколько капель раствора сульфита натрия до перехода оранжевой окраски дихромат-ионов в изумрудно-зеленую окраску ионов Cr :
Na2SO3 + K2Cr2O7 + H2SO4 -> Na2SO4 + Cr2(SO4)3 +K2SO4 + H2O
Задание: Подберите коэффициенты к данной схеме реакции методом электронного баланса.
Опыт 6. Окислительно-восстановительные свойства пероксида водорода
а) окисление ионов Mn2+ пероксидом водорода
К 3-4 каплям раствора сульфата марганца (II) добавьте 3-4 капли раствора гидроксида натрия и 3-4 капли раствора пероксида водорода. В результате взаимодействия выделяется осадок оксида марганца (IV):
MnSO4 + H2O2 + NaOH -> Na2SO4 + MnO2| + H2O
Задание: Подберите коэффициенты к данной схеме реакции методом электронного баланса.
б) восстановление перманганат-ионов пероксидом водорода
К 3-4 каплям раствора перманганата калия добавьте 3-4 капли разбавленного раствора серной кислоты и несколько капель раствора пероксида водорода до исчезновения окраски перманганата. Реакция протекает по схеме:
KMnO4 + H2O2 + H2SO4 -> MnSO4 + K2SO4 + О2| + H2O
Задание: К данной схеме реакции подберите коэффициенты методом электронного баланса.
УПРАЖНЕНИЯ
Подберите коэффициенты .Определите окислитель и восстановитель:
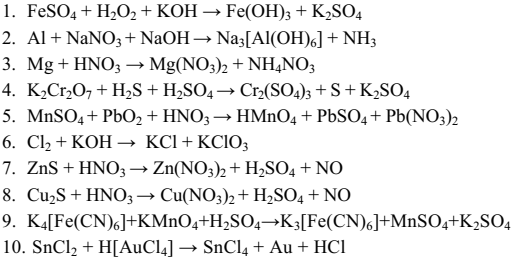
Контрольные вопросы:
1. Почему металлы не могут выполнить роль окислителя?
2. Чем определяется знак степени окисления элемента в соединении?
3. Какое значение в организме человека имеют окислительно-восстановительные реакции?
Практическое занятие №6
Тема «Комплексные соединения»
Цель работы – раскрытие сущности природы комплексных соединений и их значения в сельском хозяйстве.
Реактивы и принадлежности:
•соляная кислота, 1н. р-р;
•нитрат серебра (I), 1н. р-р;
•сульфат меди (II), 1н. р-р;
•хлорид железа (III), 1н. р-р;
•тиоцианат калия, 1н. р-р;
•нитрат висмута (III), 1н. р-р;
•иодид калия, 1н. р-р;
•хлорид кобальта (II), 1н. р-р;
• хлорид меди (II), 1н. р-р;
• сульфат никеля (II), 1н. р-р;
• гексацианоферрат (II) калия, 1н. р-р;
• соляная кислота, конц. р-р;
• гидроксид аммония, конц. р-р;
• тиоцианат калия, кристаллич;
• дистиллированная вода;
• штатив с маленькими пробирками.
Опыт 1. Соединения с комплексным катионом
а) образование комплексного катиона серебра (I)
В пробирку поместите 3-4 капли раствора нитрата серебра (I) AgNO3 и 3-4 капли раствора соляной кислоты. К выпавшему белому осадку хлорида серебра (I) по каплям добавьте концентрированный раствор гидроксида аммония NH4OH, содержимое пробирку перемешайте. Образуется растворимая комплексная соль - хлорид диамминсеребра (I).
Задание:Напишите в молекулярном и ионном виде уравнения реакций образования:
1) хлорида серебра (I);
2) комплексной соли серебра (I).
б) образование комплексного катиона меди (II)
В пробирку поместите 3-4 капли раствора сульфата меди (II) CuSO4 и по каплям добавьте концентрированный раствор гидроксида аммония. Ярко-синий цвет полученного раствора указывает на образования комплексного катиона меди (II) - [Cu(NH3)4]2+.
Задание: Напишите в молекулярном и ионном виде уравнения реакции образования сульфата тетраамминмеди (II).
Дата добавления: 2018-11-24; просмотров: 787; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
