Опыт 1. Взаимодействие солей со щелочами
Приготовьте две пробирки: в первую поместите 3 капли раствора хлорида магния; во вторую - 3 капли раствора сульфата марганца (II). В каждую пробирку добавьте по каплям раствор гидроксида натрия до образования осадков.
Задание: Напишите уравнения реакций:
1) хлорида магния с гидроксидом натрия;
2) сульфата марганца (II) с гидроксидом натрия.
Примечание: Полученные осадки гидроксидов магния и марганца сохраните для проведения опыта 2.
Опыт 2. Взаимодействие кислот и оснований
(Реакция нейтрализации)
а) нейтрализация щелочи
В пробирку поместите 5 капель раствора гидроксида натрия и 1 каплю индикатора метилоранжа. Добавьте в эту пробирку по каплям раствор серной кислоты до изменения окраски индикатора.
Задание: Напишите уравнение реакции гидроксида натрия с серной кислотой.
б) нейтрализация малорастворимых оснований
К полученному в опыте 1 осадку гидроксида магния добавьте по каплям раствор азотной кислоты, а к осадку гидроксида марганца (II) - раствор серной кислоты. Что наблюдаете?
Задание: Напишите уравнения реакций:
1) гидроксида магния с азотной кислотой;
2) гидроксида марганца (II) с серной кислотой.
Опыт 3. Получение амфотерных гидроксидов и их
взаимодействие с кислотами и щелочами
В пробирку поместите 3 капли раствора сульфата цинка. Добавьте в эту пробирку по каплям раствор гидроксида натрия до образования осадка. Содержимое пробирки разделите на две части.
К одной из них добавьте раствор соляной кислоты, а к другой - избыток раствора гидроксида натрия до растворения осадков. Задание: Напишите уравнения реакций:
1) сульфата цинка с гидроксидом натрия;
2) гидроксида цинка с соляной кислотой;
3) гидроксида цинка с гидроксидом натрия.
Опыт 4. Взаимодействие солей с кислотами
А) В пробирку поместите 5 капель раствора карбоната калия. Добавьте в эту пробирку по каплям раствор соляной кислоты. Что наблюдаете?
Задание: Напишите уравнение реакции карбоната калия с соляной кислотой.
Б) К 3 каплям раствора карбоната калия добавьте 3 капли хлорида кальция. Осторожно слейте раствор над осадком и подействуйте на осадок соляной кислотой. Что наблюдаете? Задание: Напишите уравнения реакций:
1) карбоната калия с хлоридом кальция;
2) карбоната кальция с соляной кислотой.
В) В пробирку поместите 5 капель раствора хлорида бария и по каплям добавляйте раствор серной кислоты до образования осадка.
Задание:Напишите уравнение реакции хлорида бария с серной кислотой.
Опыт 5.Взаимодействие солей с солями
В пробирку поместите по 3 капли растворов веществ, соответствующих схемам реакций:
1) Pb(NO3)2 + KI ->
2) FeCl3 + KSCN ->
3) FeSO4 + K3[Fe(CN)6] ->
4) Bi(NO3)3 + KI ->
5) AgNO3 + KCl ->
Задание: Напишите уравнения реакций. Расставьте коэффициенты. Укажите цвет полученных осадков.
УПРАЖНЕНИЯ
1.Напишите формулы следующих веществ: сульфат цинка; оксид хлора (VII); азотная кислота; гидроксид кобальта (III); хлорид гидроксожелеза (III); метасиликат алюминия; цианид кальция; хлорная кислота; дихромат лития; гидросульфит бария; нитрат меди (II); оксид натрия; дихромат натрия; перхлорат магния; нитрит свинца (II); ацетат железа (II); карбонат аммония. Укажите, к какому классу и типу относятся эти вещества.
2.С какими из перечисленных веществ будет реагировать соляная кислота: углекислый газ, оксид кальция, серная кислота, гидроксид бария, магний, карбонат калия, нитрат натрия, медь, хлорид гидроксоцинка? Составьте уравнения возможных реакций.
3.С какими из перечисленных веществ будет реагировать гидроксид натрия: оксид калия, оксид фосфора (V), азотная кислота, гидроксид кальция, гидрокарбонат натрия, нитрат калия, хлорид меди (II), гидроксид железа (III)? Составьте уравнения возможных реакций.
4. Осуществите следующие превращения:
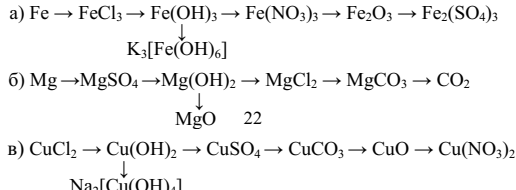
5. Для каждого из приведенных веществ: определите степени окисления химических элементов; укажите к какому классу и типу они относятся; дайте название; составьте уравнения реакций, характеризующие химические свойства.
| № варианта | Формулы соединений | |||
| 1 | HNO3 | K2O | Cu(OH)2 | Ca3(PO4)2 |
| 2 | ZnO | BaCl2 | H2SO3 | Mg(OH)2 |
| 3 | ZnSO4 | NaOH | SO2 | H2S |
| 4 | Ca(OH)2 | HCN | Cu(NO3)2 | Fe2O3 |
| 5 | H2CO3 | MgO | Fe(OH)2 | Na2SO3 |
| 6 | BaO | K2SO4 | H2SiO3 | Zn(OH)2 |
| 7 | MgCO3 | NH4OH | Na2O | HNO2 |
| 8 | Fe(OH)3 | HMnO4 | (NH4)2S | CO2 |
| 9 | H2SO4 | Cr2O3 | Al(OH)3 | Na2SO4 |
| 10 | Al2O3 | NaCl | HClO3 | Ba(OH)2 |
| 11 | NH4NO3 | Pb(OH)2 | CuO | H2CrO4 |
| 12 | Be(OH)2 | H3PO4 | CuSO4 | Ag2O |
| 13 | HClO4 | SO3 | KOH | MgCl2 |
| 14 | P2O5 | CaCO3 | HCl | Mn(OH)2 |
| 15 | K2SO3 | Cr(OH)3 | CaO | HClO2 |
6. Составьте уравнения реакций получения средних, кислых и основных солей из приведенных кислот и оснований. Назовите образующиеся соли.
| № | Формула | Формула | № | Формула | Формула |
| варианта | основания | кислоты | варианта | основания | кислоты |
| 1 | Zn(OH)2 | H2CO3 | 9 | Ba(OH)2 | H3BO3 |
| 2 | NaOH | H3PO4 | 10 | NH4OH | H2SO4 |
| 3 | Cu(OH)2 | HNO3 | 11 | Fe(OH)2 | HBr |
| 4 | Al(OH)3 | HCl | 12 | KOH | H2SiO3 |
| 5 | Ca(OH)2 | HClO4 | 13 | Co(OH)2 | HNO2 |
| 6 | Ni(OH)2 | H2S | 14 | Fe(OH)3 | HI |
| 7 | Mg(OH)2 | Н2СrO4 | 15 | Pb(OH)2 | HMnO4 |
| 8 | Сг(ОH)3 | H2SO3 | 16 | Mn(OH)2 | HCIO2 |
Контрольные вопросы:
1. Какие вещества и по какому характерному свойству объединяются в класс оксидов, оснований, кислот, солей?
2. Как осуществить превращения: неметалл – кислотный оксид – кислота – соль?
3. Как называются соли серной, азотной, угольной, соляной кислот?
Практическое занятие №2
Дата добавления: 2018-11-24; просмотров: 499; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
