Тема «Определение степени карбонатной и некарбонатной жесткости природной воды»
Цель работы – ознакомление с методикой определения степени жесткости воды.
Реактивы и принадлежности:
• оксид кальция, кристалл.;
• оксид магния, кристалл.;
• соляная кислота, 0,1 М р-р;
• карбонат натрия, 0,1 М р-р;
• водный раствор мыла;
• сульфат кальция, 0,1 М р-р;
• фарфоровые чашки, 2 шт.;
• конические колбы, 2 шт.;
• штатив;
• бюретка, 1 шт.;
• стеклянная газоотводная трубка;
• спиртовка.
Опыт 1. Взаимодействие оксидов кальция и магния с водой
Приготовьте 2 фарфоровые чашки: в первую поместите немного оксида кальция, во вторую – оксид магния. В каждую поочередно добавьте по каплям воду до растворения оксидов.
Задание:
1) Напишите уравнения реакция взаимодействия оксида кальция и оксида магния с водой с учетом теплового эффекта.
2) Полученный раствор гидроксида кальция сохраните для проведения опыта 2.
Опыт 2. Получение и распознавание карбонатов и гидрокарбонатов
В пробирке с известковой водой осуществите превращение:
Ca(OH)2 →CaCO3 → Ca(HCO3)2→ CaCO3→ CaCl2
Задание:
Напишите уравнения цепочки превращения соединения кальция.
Опыт 3. Степень жесткости природной воды
В 2 конические колбы налейте одинаковый объем природной воды из разных источников. Прибавьте по каплям водный раствор мыла из бюретки при постоянном встряхивании содержимого колбы. Отметьте объем раствора мыла, который вызвал эффект пенообразования после помутнения водной пробы в колбе.
Задание:
1) Составьте схему реакции взаимодействия мыла (соли калия и натрия органических кислот) с ионами кальция и магния, которые присутствуют в жесткой воде:
KR1 + ? →?
NaR2 + ? →?
2) По данным объема водного раствора мыла, который вызвал эффект пенообразования, сформулируйте вывод о степени жесткости анализируемых проб воды.
Опыт 4. Способы смягчения воды
Проделайте опыты, объясняющие способы смягчения воды, содержащей вещества, придающие ей постоянную и временную жесткость.
Задание:
Напишите уравнение реакций:
а) взаимодействие растворов сульфата кальция с карбонатом натрия;
б) термического разложения гидрокарбонатов магния и кальция.
УПРАЖНЕНИЯ
1. На чем основано применение фосфата натрия для смягчения воды?
2. Напишите уравнение реакции раствора нитрата магния с известковой водой.
Контрольные вопросы:
1. Как смягчить воду, не применяя химических реактивов?
2. Какая вода более жесткая: дождевая или речная? Почему?
3. Как объяснить, что насыщенный раствор гидроксида кальция называется «известковое молоко»?
Практическое занятие №9
Тема «Приготовление стандартного раствора щавелевой кислоты»
Цель работы – отработка экспериментально-расчетных умений и навыков приготовления растворов.
Стандартный раствор готовят из химически чистой щавелевой кислоты. Молярную массу эквивалента щавелевой кислоты рассчитывают, исходя из реакции взаимодействия с гидроксидом натрия, протекающей по уравнению:
H2C2О4 + 2NaOH = Na2C2О4 + 2Н2О
H2C2О4 + 2OH– = C2О4– + 2Н2О
Из уравнения следует: _____________________________________________
____________________________________________________________________________________________________________________________________________
Расчет навески для приготовления первичного стандартного раствора ведут по формуле:___________________________________________________________
_______________________________________________________________________________________________________________________________________
Ход работы
Рассчитанную навеску щавелевой кислоты взвешивают в бюксе сначала на технических весах, а затем точно на аналитических весах. Навеску через воронку количественно переносят в мерную колбу, растворяют в дистиллированной воде, добавляют воды до метки и тщательно перемешивают.
Протокол работы
1.1. Масса пустого бюкса на технических весах
1.2. Масса пустого бюкса на аналитических весах
1.3. Масса бюкса с навеской на технических весах
1.4. Масса бюкса с навеской на аналитических весах
1.5. Масса навески
Расчет результатов работы
3.1. Расчет молярной концентрации эквивалента H2C2О4 · 2Н2О
3.2. Расчет титра H2C2О4 · 2Н2О
3.3. Расчет поправочного коэффициента
Вывод: приготовлен раствор первичного стандарта H2C2О4 · 2Н2О по точной навеске с K = _____ к 0,1 н. раствору.
Контрольные вопросы:
1. Какая расчетная формула для молярной концентрации раствора?
2. Какие растворы называются разбавленными, концентрированными, насыщенными?
3. Сформулируйте основные положения современной физико-химической теории растворения?
Практическое занятие №10
Тема «Определение концентрации раствора гидроксида натрия»
Цель работы – отработка алгоритма проведения кислотно-основного титрования.
Для проведения титриметрического определения необходимо прежде всего приготовить стандартный (рабочий) раствор титранта.
Стандартные растворы готовят с использованием аналитических весов и точной мерной посуды (бюретки, пипетки, мерные колбы). Концентрацию их записывают с точностью до четвертой значащей цифры.
Классификация стандартных растворов и все возможные способы их приготовления представлены на схеме.

Первичный стандартный раствор можно приготовить сразу с точно известной концентрацией и не стандартизировать.
Способы приготовления первичных стандартных растворов:
1.Из кристаллического стандартного вещества(установочного вещества, исходного вещества, первичного стандарта). Взвешивают на аналитических весах точную навеску стандартного вещества, переносят в мерную колбу, растворяют в дистиллированной воде, затем доводят до метки (рис. 1).

Рис. 1. Приготовление первичного стандартного раствора из кристаллического стандартного вещества
Ориентировочную массу навески вещества для приготовления раствора рассчитывают по формуле

После взятия навески и ее растворения в мерной колбе рассчитывают точную концентрацию приготовленного раствора по формуле
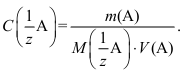
Кристаллическое вещество для приготовления первичного стандартного раствора должно соответствовать ряду требований:
– состав вещества должен строго соответствовать егоформуле;
– вещество должно быть устойчиво на воздухе (не должно окисляться, поглощать СО2, Н2О) при хранении в твердом состоянии и в растворе;
– вещество должно быть хорошо растворимым, нелетучим, желательнобезводным;
– вещество должно быть чистым;
– вещество должно легко очищаться от примесей перекристаллизацией;
– вещество должно иметь большую молярную массуэквивалента
(тогда ошибка при взятии навески будет меньше);
– вещество должно быть доступным инедорогим.
Если взять такое вещество, взвесить его на аналитических весах и растворить в мерной колбе, то получится первичный стандартный раствор.
2. Из фиксанала (стандарт-титра). Фиксанал – это точно отвешенная масса твердого вещества «х. ч.», или точно отмеренный объем его раствора, помещенные в запаянные стеклянные ампулы. Содержимое ампулы 1 переносят через воронку 2 в мерную колбу 4, разбивая бойком 3, разбавляют до метки и получают раствор с точно известной концентрацией (рис. 2).
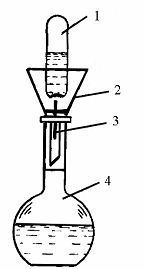
Рис. 2. Приготовление первичного стандартного раствора из фиксанала
Применение фиксаналов значительно сокращает время на приготовление стандартныхрастворов.
Поскольку чаще всего в ампуле содержится 0,1 моль-экв вещества, то концентрацию стандартного раствора, приготовленного изфиксанала в мерной колбе вместимостью V,находят по формуле
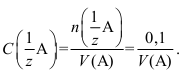
Вторичный стандартный раствор готовят в два этапа.
1. Готовят раствор с примерно известной концентрацией из кристаллического вещества или из более концентрированного раствора, используя технические весы и мерную посуду с ориентировочными делениями (мерные цилиндры, стаканы сделениями).
2. Определяют его точную концентрацию (стандартизируют) путем титрования первичного стандартногораствора.
В лабораторной работе рабочие растворы HCl и NaOH готовят как вторичные стандарты путем разбавления более концентрированных растворов с последующей стандартизацией по первичным стандартным растворам тетрабората натрия Na2B4O7* 10H2O и щавелевой кислоты Н2С2O4* 2H2O. При титровании протекают следующие реакции:
Na2B4O7 + 2HCl + 5H2O = 2NaCl + 4Н3BO3
 (fэкв(Na2B4O7) = 0,5, fэкв(HCl) = 1);
(fэкв(Na2B4O7) = 0,5, fэкв(HCl) = 1);
Н2С2O4 + 2NaOH = Na2С2O4 + 2Н2O,
 (fэкв(Н2С2O4) = 0,5, fэкв(NaOH) = 1).
(fэкв(Н2С2O4) = 0,5, fэкв(NaOH) = 1).
Концентрацию растворов установочных веществ задают близкой к концентрации рабочихрастворов.
Оборудование и реактивы: технические и аналитические весы, электрическая плитка, мерные цилиндры (10–25 мл, 250 мл), стаканы с делениями (500 мл), денсиметр (ареометр), склянки с этикетками для хранения рабочих растворов, мерная колба, пипетка, бюретка, колбы для титрования, тигель, Na2B4O7* 10H2O (х. ч.), Н2С2O4* 2H2O (х. ч.), концентрированные растворы HCl и NaOH (или KOH), индикаторы метиловый оранжевый ифенолфталеин.
Выполнение работы
1. Приготовление разбавленных растворов HCl иNaOH:
– с помощью денсиметров измеряют плотности концентрированных растворов HCl иNaOH;
– по справочнику находят их молярные концентрации(моль/л);
– рассчитывают объемы концентрированных растворов HCl и NaOH, необходимые для приготовления 500 мл (или 300 мл по указанию преподавателя) 0,1 н.растворов;
– цилиндрами отмеряют рассчитанные объемы HCl и NaOH, переносят их в стаканы вместимостью 500 мл и разбавляют дистиллированной водой до нужногообъема;
– приготовленные растворы HCl и NaOH переливают в подписанные склянки для хранения, закрывают пробками и тщательно перемешивают.
Приготовленные растворы HCl и NaOH имеет приблизительно известную концентрацию, поэтому их необходимо стандартизировать.
2. Приготовление первичного стандартного раствораNa2B4O7:
– рассчитывают ориентировочную массу установочного вещества Na2B4O7* 10H2O, необходимую для приготовления 100 мл 0,1 н. раствора;
– установочное вещество взвешивают в тигле на технических, а затем на аналитическихвесах;
– навеску аккуратно пересыпают через воронку в мерную колбу, тигельсоставшимисянастенкахчастицамиNa2B4O7*10H2Oсновавзвешивают на аналитических весах;
– по разности двух взвешиваний на аналитических весах находят массу Na2B4O7* 10H2O, перенесенного вколбу;
– смывают навеску в колбу струей горячей дистиллированной воды, заполняют колбу на 2/3 объема водой. Снимают с колбы воронку и, перемешивая содержимое колбы круговыми движениями, добиваются полного растворения Na2B4O7* 10H2O. Затем доводят содержимое колбы до метки дистиллированной водой и тщательно перемешивают раствор, многократно переворачиваяколбу;
– вычисляют молярную концентрацию эквивалента Na2B4O7 с точностью до четвертой значащей цифры и приступают ктитрованию.
3. Установление точной концентрации приготовленного раствора HCl(стандартизация):
– вымытую бюретку ополаскивают небольшим количеством приготовленного рабочего раствора HCl и заполняют ее этимраствором;
– в чистую коническую колбу переносят пипеткой определенный объем (аликвоту) приготовленного раствора установочного вещества Na2B4O7, прибавляют 1–2 капли индикатора метилового оранжевого и начинают титровать, перемешивая жидкость круговым движением колбы. Титрование прекращают, как только произойдет резкое изменение окраскираствора;
– титрование повторяют несколько раз, пока не будет получено не менее трех значений объема титранта, различающихся между собой не более чем на 0,1 мл. Все полученные результаты должны обязательно заноситься в лабораторный журнал, даже если они и одинаковые.
– рассчитывают средний объем титранта, учитывая только те значения, которые различаются не более чем на 0,1мл;
– по результатам титрования находят точную молярную концентрацию эквивалента приготовленного рабочего раствораHCl.
В некоторых случаях по указанию преподавателя рабочий раствор HCl может быть приготовлен из фиксанала или установление концентрации его может быть проведено по стандартному раствору щелочи, Na2CO3 или NaHCO3.
4. Приготовление первичного стандартного раствораН2С2O4:
– рассчитывают ориентировочную массу установочного вещества Н2С2O4* 2H2O, необходимую для приготовления 100 мл 0,1 н. раствора;
– установочное вещество взвешивают в тигле на технических,азатем на аналитических весах;
– навеску аккуратно пересыпают через воронку в мерную колбу, тигель с оставшимися на стенках частицами Н2С2O4* 2H2O снова взвешивают на аналитическихвесах;
– по разности двух взвешиваний на аналитических весах находят массу Н2С2O4* 2H2O, перенесенной вколбу;
– смывают навеску в колбу струей дистиллированной воды, заполняют колбу на 2/3 объема водой. Снимают с колбы воронку и, перемешивая содержимое колбы круговыми движениями, добиваются полного растворения Н2С2O4 2H2O. Затем доводят содержимое колбы до метки дистиллированной водой и тщательно перемешивают раствор, многократно переворачиваяколбу;
– вычисляют молярную концентрацию эквивалента Н2С2O4 с точностью до четвертой значащей цифры и приступают ктитрованию.
5. Установление точной концентрации приготовленного раствора NaOH(стандартизация):
– вымытую бюретку ополаскивают небольшим количеством при- готовленного рабочего раствора NaOH и заполняют ее этим раствором;
– в чистую коническую колбу переносят пипеткой определенный объем (аликвоту) приготовленного раствора установочного вещества Н2С2O4, прибавляют 1–2 капли индикатора фенолфталеина и начинают титровать, перемешивая жидкость круговым движением колбы. Титрование прекращают, как только появится неисчезающая розовая окраскараствора;
– титрование повторяют несколько раз, пока не будет получено не менее трех значений объема титранта, различающихся между собой не более чем на 0,1 мл. Все полученные результаты должны обязательно заноситься в лабораторный журнал, даже если они и одинаковые;
– рассчитывают средний объем титранта, учитывая только те значения, которые различаются не более чем на 0,1мл;
– по результатам титрования находят точную молярную концентрацию эквивалента приготовленного рабочего раствораNaOH.
В некоторых случаях по указанию преподавателя рабочий раствор NaOH может быть приготовлен из фиксанала или установление концентрации его может быть проведено по стандарт- ному раствору HCl.
Степеньчистотыреактивоввозрастаетвряду:техн.(технический);ч. (чистый); ч. д. а. (чистый для анализа);х. ч. (химически чистый);ос. ч. (особой чистоты).
Плотности и концентрации растворов HCl при 200С
| Плотность, г/мл | ω, мас. % | С, моль/л | Плотность, г/мл | ω, мас. % | С, моль/л |
| 1,090 | 18,43 | 5,509 | 1,120 | 24,25 | 7,449 |
| 1,100 | 20,39 | 6,150 | 1,130 | 26,20 | 8,118 |
| 1,110 | 22,33 | 6,796 | 1,140 | 28,18 | 8,809 |
Плотности и концентрации растворов щелочей при 200С
| NaOH | KОН | ||||
| Плотность, г/мл | ω, мас. % | С, моль/л | Плотность, г/мл | ω, мас. % | С, моль/л |
| 1,090 | 8,28 | 2,257 | 1,100 | 11,03 | 2,15 |
| 1,100 | 9,19 | 2,527 | 1,105 | 11,56 | 2,28 |
| 1,110 | 10,10 | 2,802 | 1,110 | 12,08 | 2,39 |
| 1,120 | 11,01 | 3,082 | 1,115 | 12,61 | 2,51 |
| 1,130 | 11,92 | 3,367 | 1,120 | 13,14 | 2,62 |
| 1,140 | 12,83 | 3,655 | 1,125 | 13,66 | 2,74 |
Контрольные вопросы:
1. В чем заключается сущность реакции нейтрализации?
2. Что называется точкой эквивалентности в титриметрическом методе анализа?
3. Какая химическая реакция лежит в основе кислотно-основного титрования?
Практическое занятие №11
Дата добавления: 2018-11-24; просмотров: 350; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
