Опыт 2. Соединения с комплексным анионом
а) образование комплексного аниона железа (III)
К 2-3 каплям раствора хлорида железа (III) FeCl3 добавьте 23 капли раствора тиоцианата калия KSCN. Интенсивное кроваво-красное окрашивание принадлежит тиоцианатным комплексам железа (III) - [Fe(SCN)6]3- .
Задание: Напишите в молекулярном и ионном виде уравнения реакции образования гексатиоцианатоферрата (III) калия.
б) образование комплексного аниона висмута (III)
К 3-4 каплям раствора нитрата висмута (III) Bi(NO3)3 добавьте 2-3 капли раствора иодида калия KI до выпадения черного осадка иодида висмута (III). Затем в эту пробирку добавьте избыток раствора иодида калия до полного растворения осадка. Обратите вниманиена цвет полученного комплексного аниона висмута (III) - [BiI4] .
Задание: Напишите в молекулярном и ионном виде уравнения реакции образования тетраиодовисмутата (III) калия.
в) образование комплексных анионов кобальта (II) и меди (II)
В одну пробирку поместите 3-4 капли раствора хлорида кобальта (II), а в другую - 3-4 капли раствора хлорида меди (II).
В каждую пробирку прилейте по каплям концентрированную соляную кислоту до изменения окраски. В первой пробирке наблюдается синее окрашивание комплексного аниона кобальта (II) - [CoCl4]2- , во второй пробирке - зеленое окрашивание комплексного аниона меди (II) - [CuCl4]2-.
Задание: Напишите в молекулярном и ионном виде уравнения реакций:
1) образования тетрахлорокобальтата (II) водорода;
2) образования тетрахлорокупрата (II) водорода.
Опыт 3. Соединение с комплексными катионом и анионом
В пробирку с 2 каплями раствора сульфата никеля (II) NiSO4 добавьте 8 капель концентрированного раствора гидроксида аммония. Образуется комплексный катион никеля (II) - [Ni(NH3)d2+.
Разбавьте полученный раствор равным объемом дистиллированной воды и добавьте 2 капли раствора гексацианоферрата (II) калия K4[Fe(CN)6]. Содержимое
пробирки перемешайте. Из раствора постепенно выделяются бледно-лиловые игольчатые кристаллы гексацианоферрата (II) гексаамминникеля (II).
Задание: Напишите в молекулярном и ионном виде уравнения реакций:
1) образования сульфата гексаамминникеля (II).
2) взаимодействия раствора сульфата гексаамминникеля (II) с раствором гексацианоферрата (II) калия.
Опыт 4. Устойчивость комплексных ионов
а) константа устойчивости комплексных ионов
В пробирку поместите 3-4 капли раствора хлорида кобальта (II) и добавьте немного кристаллического тиоцианата калия до образования, окрашенного в синий цвет комплексного аниона кобальта (II) - [Co(SCN)4]2-.
К полученному раствору по каплям прилейте концентрированный раствор гидроксида аммония до появления грязно-желтой окраски комплексного катиона кобальта (II) - [Co(NH3)6]2+.
Задание:
1. Напишите в молекулярном и ионном виде уравнения реакций образования и разрушения тетратиоцианатокобальтата (II) калия;
2. Объясните результат опыта, сравнив значения констант устойчивости:
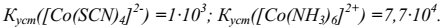
б) влияние концентрации на комплексообразование
К 3-4 каплям раствора хлорида кобальта (II) добавьте немного кристаллического тиоцианата калия до образования, окрашенного в синий цвет комплексного аниона кобальта (II) - [Co(SCN)4]2-. Полученный раствор разбавьте водой до появления розовой окраски, характерной для аквакомплекса кобальта (II) - [Co(H2O)6]2+.
Задание: Напишите в молекулярном и ионном виде уравнения реакции образования аквакомплекса тиоцианата гексааквакобальтата (II).
УПРАЖНЕНИЯ
1. Укажите комплексообразователь, его степень окисления, лиганды, координационное число, внутреннюю и внешнюю сферы комплекса, напишите схему диссоциации следующих комплексных солей:
а) гексахлороплатинат (IV) калия; в) хлорид тетраамминцинка;
б) тетраиодомеркурат (II) кальция; г) сульфат тетрааквамеди (II).
2. Дайте название комплексному соединению и составьте выражения констант устойчивости:
а) K4[Fe(CN)6]; в) K[AuCl4];
б) [Fe(H2O)6]SO4; г) [Ni(NH3)6](NO3)2.
3. Координационное число Pt4+ равно 6. Напишите формулы возможных комплексов, образованных этим ионом в качестве комплексообразователя, молекулами NH3 и ионами Cl в качестве лигандов. Назовите эти соединения.
Контрольные вопросы:
1. На что указывает координационное число в комплексном соединении?
2. Чем отличаются гемоглобин и хлорофилл с точки зрения природы центрального атома комплексного соединения?
3. Сохраняются или нет свойства комплексного соединения в растворенном и твердом состоянии?
Практическое занятие №7
Дата добавления: 2018-11-24; просмотров: 455; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
