Тема «Приготовление стандартизированного раствора серной кислоты. Определение концентрации раствора серной кислоты»
Цель работы – отработка алгоритма проведения кислотно-основного титрования.
Реагенты: Щавелевая кислота H2C2О4 · 2Н2О; 0,1н раствор (первичный стандарт), Гидроксид натрия NaOH (или калия КОН); 0,1н раствор (вторичный стандарт, титрант), Индикатор - фенолфталеин.
I. Установление концентрации раствора NaOH
Концентрацию (С, Т) NaOH устанавливают по первичному стандартному раствору исходного вещества, например, по щавелевой кислоте.
Ход работы
Бюретку тщательно промывают водой и ополаскивают приготовленным раствором NaOH; затем, подставив под неё стакан, открывают зажим и заполняют раствором оттянутый кончик бюретки, чтобы в нем не осталось пузырьков воздуха. Устанавливают уровень NaOH в бюретке на нуле.
Мерную пипетку ополаскивают стандартным раствором щавелевой кислоты, после чего отмеряют 10 мл его и переносят в коническую колбу; прибавляют 2 – 3 капли фенолфталеина и титруют при непрерывном помешивании раствором NaOH до появления бледно-розовой окраски, не исчезающей около 30 секунд.
При этом протекает реакция по уравнению:
H2C2O4 + NaOH = Na2C2O4 + 2H2O
Титрование проводят не менее трех раз до получения сходящихся результатов (+/ – 0,1мл).
Протокол работы
2.1. Объём раствора щавелевой кислоты взятый для титрования
2.2. Объём раствора щелочи, пошедший на первое титрование
2.3. Объём раствора щелочи, пошедший на второе титрование
2.4. Объём раствора щелочи, пошедший на третье титрование
2.5. Средний объём раствора щелочи
Расчет результатов работы
3.1. Расчет молярной концентрации эквивалента щелочи:
3.2. Расчет титра гидроксида натрия:
3.3. Расчет поправочного коэффициента:
Вывод: установлена точная концентрация NaOH с K = _____ к 0,1н.
II. Определение содержания серной кислоты в растворе
Ход работы
Полученный объём анализируемого раствора серной кислоты в мерной колбе доводят дистиллированной водой до метки и тщательно перемешивают. Мерную пипетку ополаскивают приготовленным раствором серной кислоты, отбирают 10 мл этого раствора в коническую колбу и добавляют 2–3 капли фенолфталеина.
Титрант – раствор гидроксида натрия NaOH – наливают в бюретку и устанавливают уровень раствора на нуле, заполнив кончик бюретки. Раствор серной кислоты титруют при перемешивании раствором NaOH до появления, неисчезающей в течение 30 сек. бледно-розовой окраски. Титрование повторяют 2–3 раза.
Протокол работы
2.1. Объём раствора H2SO4, взятый для титрования.
2.2. Объём раствора NaOH, пошедший на первое титрование
2.3. Объём раствора NaOH, пошедший на второе титрование
2.4. Объём раствора NaOH, пошедший на третье титрование
2.5. Средний раствор объём щелочи
Расчет результатов работы
3.1. Расчет молярной концентрации эквивалента H2SO4
3.2. Расчет титра гидроксида натрия по серной кислоте
3.3. Содержание (масса) H2SO4 в объёме мерной колбы:
Контрольные вопросы:
1. Что является аналитическим сигналом в кислотно-основном методе титрования?
2. Дайте определение понятия «точка эквивалентности»?
3. Какая химическая посуда служит для измерения объема раствора?
Практическое занятие №12
Т ема «Определение общей жесткости воды комплексометрическим методом»
Цель работы – ознакомление с методикой комплексометрического метода титрования.
Сущность работы. Ионы Са2+ и Mg2+ образуют комплексонаты, которые устойчивы в щелочной среде, поэтому их титруют стандартным раствором ЭДТА в присутствии аммиачного буфера. Если использовать индикатор эриохром черный Т, то в к. т. т. наблюдается переход окраски раствора от сиреневой (комплексы индикатора с Са2+ и Mg2+) к синей (свободная форма индикатора в этих условиях).
Жесткость воды – это суммарный показатель качества воды. Она обусловлена наличием ионов Са2+ и Mg2+. Общая жесткость воды показывает, сколько миллимоль эквивалентов Са2+ и Mg2+ в сумме содержится в 1 лводы.
Суммарное содержание Са2+ и Mg2+ определяют прямым титрованием пробы воды в аммонийном буфере стандартным раствором ЭДТА в присутствии индикатора эриохрома черного Т:
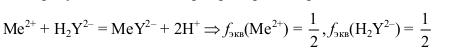
Поскольку концентрация Са2+ и Mg2+ в воде незначительна, для титрования берут большие аликвоты анализируемой воды (50,00 или 100,00 мл) с помощью специальных пипеток большой вместимости.
Раздельное определение Са2+и Mg2+при совместном присутствии в растворе основано на титровании пробы с разными индикаторами в разных условиях.
Сначала определяют суммарное содержание кальция и магния в пробе. С этой целью титруют аликвоту анализируемого раствора комплексоном III с индикатором эриохромом черным Т в среде аммиачного буфера. При этом протекают следующие реакции:
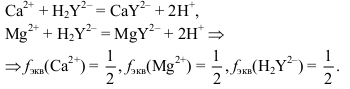
Затем определяют содержание кальция, титруя такую же аликвоту раствором ЭДТА с индикатором мурексидом в сильнощелочной среде. При добавлении щелочи ионы магния маскируются за счет осаждения в виде Mg(OH)2 и не реагируют с ЭДТА. Следовательно, титруются только ионы кальция:
Ca2+ + H2Y2– = CaY2– + 2H+
Свободная форма индикатора мурексида в этих условиях имеет сиренево-фиолетовую окраску, а комплекс его с кальцием – кирпично- красную. Содержание магния в пробе находят по разности.
Оборудование и реактивы: бюретка, мерный цилиндр (25 мл), стандартный раствор ЭДТА, аммиачный буфер с рН 9, индикатор эриохром черный Т в смеси с NaCl (1 : 100). Для анализа пробы А дополнительно: пипетка Мора большой вместимости (50,00 или 100,00 мл), конические колбы большой вместимости (250 мл). Для анализа пробы Б дополнительно: мерная колба, пипетка Мора, конические колбы, гранулированный NaOH, мурексид в смеси с NaCl (1 :100).
Выполнение работы
Проба А. Определение общей жесткости воды. Получают у лаборантов анализируемый раствор в коническую колбу. Отбирают пипеткой аликвоту 50,00 или 100,00 мл и переносят в другую коническую колбу. Прибавляют 20–25 мл аммонийного буфера, индикатор на кончике шпателя и титруют раствором комплексона III до перехода окраски раствора от сиреневой ксиней.
По результатам титрования рассчитывают общую жесткость воды
(ммоль-экв/л):
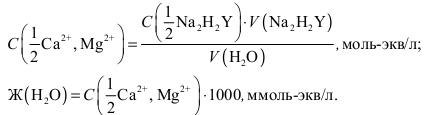
Делают вывод о характеристике воды, используя справочные данные.
Контрольные вопросы:
1. Какой тип химической реакции лежит в основе комплексометрического метода анализа?
2. Наличие каких ионов в растворе обуславливает изменения окраски индикатора?
3. Какой способ выражения концентрации раствора трилона-Б используется в эксперименте?
Практическое занятие №13
Дата добавления: 2018-11-24; просмотров: 795; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
