Тема «Свойства s-, р- и d-элементов»
Цель работы – закрепление теоретического материала, использование полученных знаний на профессиональном уровне.
Реактивы и принадлежности:
• тиосульфат натрия, 0,1М р-р;
• серная кислота, 0,1М р-р;
• хлорид железа (III), насыщ. р-р;
• тиоцианат калия, насыщ. р-р;
• хлорид калия, кристаллич;
•хлорид бария, 0.1 М р-р;
• хлорид магния, 0,1 М р-р;
• карбонат калия, 0,1 М р-р;
• сульфат натрия, 0,1 М р-р;
• гидроксид натрия, 0,1 М р-р;
• хлорид аммония, 0,1 М р-р;
• хлорид меди (II), 0,1 М р-р;
• нитрат серебра, 0,1 М р-р;
• дистиллированная вода;
• штатив с большими пробирками;
• штатив с маленькими пробирками;
• бюретки 3 шт .;
• резиновые пробки;
• секундомер;
• спиртовка, 1 шт.;
• универсальная индикаторная бумага;
• бумага миллиметровая.
Опыт 1. Экспериментальные задачи
а) пользуясь имеющимися реактивами, получите сульфат бария, гидроксид меди (II), карбонат магния;
б) взяв в качестве исходного вещества хлорид железа (III), получите оксид железа (III);
в) докажите опытным путем, что в состав хлорида аммония входят ионы аммония и хлора.
Задание:
Напишите уравнение реакции получения перечисленных в опыте соединений и доказательства состава хлорида аммония.
Опыт 2. Зависимость скорости реакции от
концентрации реагирующих веществ
Изучим влияние концентрации реагирующих веществ на скорость реакции на примере взаимодействия тиосульфата натрия с серной кислотой, которая сопровождается выделением осадка серы (гидрозоля):
Na2S2O3 + H2SO4 ^ Na2SO4 + S2 + SO2| + H2O
Скорость данной реакции (при постоянной температуре) определяется в интервале времени от начала смешивания реагирующих веществ до появления помутнения (образования гидрозоля серы). В каждом опыте чувствительность человеческого глаза позволяет определить начало помутнения при одинаковой концентрации выделившихся продуктов, поэтому при разных концентрациях реагентов скорость данной реакции будет обратно пропорциональна времени помутнения раствора.
Методика эксперимента
Заполните три бюретки:
• первую - дистиллированной водой;
• вторую - 0,1М раствором тиосульфата натрия (Na2S2O3);
• третью - 0,1 М раствором серной кислоты.
Возьмите две большие пробирки: в первую с помощью бюретки отмерьте 6 мл раствора серной кислоты; во вторую - определенное количество тиосульфата натрия и дистиллированной воды. Объемы тиосульфата натрия и воды в каждом варианте опыта представлены в таблице:
Таблица 1
| № опыта | Объем, мл | Концентрация Na2S2O3, моль/л | Время помутнения, с | Относительная скорость ( Vотн) | ||
| Na2S2O3 | H2O | H2SO4 | ||||
| 1 | 6 | — | 6 | 0,100 | ||
| 2 | 4 | 2 | 6 | 0,067 | ||
| 3 | 3 | 3 | 6 | 0,050 | ||
| 4 | 2 | 4 | 6 | 0,033 | ||
Быстро смешайте растворы, отметьте время начала реакции (с помощью секундомера), пробирку закройте пробкой и тщательно перемешайте. Наблюдайте начало помутнения, остановите секундомер и запишите время помутнения в таблицу 1.
Помойте пробирки и повторите опыт с другими концентрациями тиосульфата натрия. В каждом из вариантов опыта старайтесь дождаться одинаковой интенсивности помутнения.
Задание:
1) Рассчитайте относительную скорость реакции по формуле:
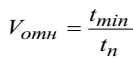
2) Постройте график зависимости относительной скорости реакции от концентрации тиосульфата натрия.
3) Напишите математическое выражение закона действующих масс для исследуемой реакции.
4) Сделайте вывод о влиянии концентрации реагирующих веществ на скорость химической реакции.
Опыт 3. Влияние концентрации на смещение
химического равновесия
Реакция взаимодействия между хлоридом железа (III) и тиоцианатом калия является обратимой:
FeCl3 + 3KSCN <-> Fe(SCN)3 + З KC1
Образующийся в результате реакции раствор тиоцианата железа (III) окрашен в кроваво-красный цвет, интенсивность которого зависит от концентрации, как реагентов, так и продуктов реакции, поэтому смещение химического равновесия можно наблюдать по изменению окраски реакционной смеси.
Методика эксперимента
В большую пробирку налейте 10 мл дистиллированной воды. Добавьте 3 капли насыщенного раствора хлорида железа (III) и 3 капли насыщенного раствора тиоцианата калия, закройте пробирку пробкой и перемешайте растворы.
Полученный раствор разлейте поровну в четыре маленькие пробирки: в первую пробирку добавьте 1 каплю насыщенного раствора хлорида железа (III); во вторую пробирку - 1 каплю насыщенного раствора тиоцианата калия; в третью пробирку - с помощью шпателя добавьте немного кристаллического хлорида калия, взболтайте; четвертую пробирку оставьте для сравнения (контроль).
Обратите внимание на изменение интенсивности окраски реакционной смеси в пробирках 1, 2, 3 по сравнению с контрольной. В соответствии с наблюдениями заполните таблицу 2.
Таблица 2
| № пробирки | Добавленное вещество | Изменение интенсивности окраски | Направление смещения равновесия |
| 1 | |||
| 2 | |||
| 3 |
Задание:
1) Для рассматриваемой реакции напишите математическое выражение константы равновесия.
2) На основании принципа Ле Шателье сделайте вывод о влиянии концентрации веществ на смещение химического равновесия.
УПРАЖНЕНИЯ
1. Составьте формулы электронной конфигурации внешнего слоя атомов элементов подгруппы азота.
2. Даны металлы: алюминий, медь, серебро, олово и растворы их солей. Напишите ионные уравнения осуществимых реакций между названными металлами и солями.
3. Во сколько раз увеличится скорость реакции:

при увеличении общего давления в 2 раза?
4. Вычислите температурный коэффициент скорости реакции, если при повышении температуры на 40°С ее скорость возрастает в 16 раз.
5. В каком направлении сместится равновесие реакции:

а) при понижении температуры; б) при повышении давления? Напишите математическое выражение константы равновесия.
Контрольные вопросы:
1. В какие группы и подгруппы периодической таблицы входят элементы s-, р- и d типов?
2. От атома какого элемента – лития или калия – легче оторвать электрон внешнего слоя?
3. На каком свойстве йода основано применение йодной настойки?
4. Увеличится ли выход продуктов реакции:

при одновременном повышении температуры и давления?
Практическое занятие №8
Дата добавления: 2018-11-24; просмотров: 257; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
