ПАТОГЕНЕЗ ЮВЕНИЛЬНОГО РЕВМАТОИДНОГО АРТРИТА
Патогенез ювенильного ревматоидного артрита как одной из клинических форм ревматических болезней интенсивно изучается в последние годы с учетом новых данных на клеточно-молекулярном и генетическом уровнях. Выявлено, что в основе развития болезни лежит активация как клеточного, так и гуморального звена иммунитета. Преобладание реакций того или другого вида определяется в основном степенью преимущественной дифференцировки Т-лимфоцитов-хелперов 1-го или 2-го типа и спектром цитокинов, которые они вырабатывают в ответ на антигенную стимуляцию.
Иммунный ответ против чужеродного (вирусного или бактериального) антигена, обнаруживаемого в тканях сустава, включает формирование цитотоксических клеток и специфических антител, перекрестно реагирующих и с собственными антигенами суставов. В экспериментальных исследованиях показано, что после вакцинации мышей адьювантом Фрейнда перекрестный цитотоксический ответ против специфических эпитопов микобактерии туберкулеза направлен также против антигенов протеогликана хряща.
Допускают, что в геноме постоянно подвергающихся антигенным воздействиям (и поэтому активно пролиферирующих) лимфоцитов синовиальной оболочки нарастает частота мутаций, в результате чего появляются клоны клеток с измененным генотипом. Такие клеточные клоны клеток с измененным генотипом. Такие клеточные клоны воспринимают антигены нормальных тканей сустава как «чужие» и развивают против них иммуноагрессивных ответ. При этом не исключается возможность проявления и первичного – «суставного» - антигена. Таким образом, в тканях сустава развивается реакция Т- и В-лимфоцитов на экзогенные и эндогенные антигены. В одних случаях это реакция нормальных иммунокомпетентных клеток на чужеродные или изменившиеся собственные антигены, а в других – мутировавших Т-лимфоцитов на нормальные аутоантигены.
|
|
|
Роль цитокинов в механизме развития ювенильного ревматоидного артрита.
Цитокины при ювенильном ревматоидном артрите могут продуцироваться различными клетками, но в наибольшей мере – лейкоцитами. Эти цитокины обозначают как интерлейкины. Кроме того, лейкоциты способны синтезировать γ-интерферон, ФНО-α и ФНО-β.
Интерлейкины в зависимости от их преимущественного влияния на тот или иной процесс разделяют на две группы. К одной группе относят ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-9 и ИЛ-10, они участвуют преимущественно в иммунорегуляции, в частности, модифицируют пролиферацию и дифференцировку лимфоцитов; к другой группе – ИЛ-1, ИЛ-6, ИЛ-х8 и ФНО-α. Эти цитокины участвуют преимущественно в развитии воспалительной реакции.
|
|
|
Предшественники Т-лимфоцитов (Th0) дифференцируются на два основных типа Т-хелперов. Направление и степень специализации Т-лимфоцитов во многом отражают природу антигенных стимулов, взаимодействующих с определенными клетками. Поляризация Th1/ Th2 определяется и при инфекционных болезнях: лейшманиозе, листериозе, инфицированности микобактериями и гельминтами, а также при наличии неинфекционных персистирующих антигенов, в частности при аллергии и иммунных аутоагрессивных болезнях. Более того, дифференцировка лимфоцитов повышается при хроническом воспалении и иммунном ответе. Дифференцировка Т-хелперов индуцируется в основном воздействием двух цитокинов – ИЛ-12 и ИЛ-4. ИЛ-12 продуцируется антигенпрезентирующими клетками, в частности моноцитами и дендритными клетками, и вызывает дифференцировку Th0 в Th1, которые принимают участие в активации клеточного звена иммунитета. ИЛ-4 способствует дифференцировке Th0 в Th2, активирующие гуморальное звено иммунитета. Эти два пути созревания Т-лимфоцитов альтернативны (например, ИЛ-4 и ИЛ-10, продуцируемые Th2-типом, ингибируют активацию Th1-типа). Th1 синтезируют ИЛ-2, γ-интерферон, ФНО-β, которые вызывают активацию клеточного звена иммунитета. Th2 синтезируют ИЛ-4,ИЛ-5,ИЛ-6,ИЛ-10 и ИЛ-13 – цитокины, способствующие активации гуморального звена иммунитета. Th0 могут продуцировать оба вида цитокинов.
|
|
|
Цитокины подразделяются также на про- и антивоспалительные (последние обозначают еще как ингибиторы цитокинов). К провоспалительным цитокинам относят ИЛ-1, ФНО-α, ИЛ-6, γ-интерферон, а к антивоспалительным – ИЛ-4, ИЛ-10 и ИЛ-13, рецептор-антагонист ИЛ-1, трансформирующий фактор-β и растворимый рецептор к ФНО. Дисбаланс про- и антивоспалительных цитокинов во многом определяет течение воспаления. Оно может быть острым, как, например, при болезни Лайма (когда отмечается значительное повышение ИЛ-1 и ФНО- α), или хроническим, как при аутоагрессивных иммунных заболеваниях. Длительный дисбаланс цитокинов может быть следствием персистирования антигена или генетических изменений. При таком дисбалансе иммунный ответ на триггерный агент может приобрести аутоагрессивное течение.
Анализ особенностей клеточного иммунного ответа при различных вариантах ювенильного ревматоидного артрита показывает при системном варианте смешанный Th1/Th2- ответ с преобладанием активности хелперов 1-го типа. Пауциартикулярный и полиартикулярный варианты ювенильного ревматоидного артрита больше ассоциируются с активацией гуморального звена иммунитета и продукцией антител, следовательно, с преимущественной активностью хелперов 2-го типа.
|
|
|
Биологический эффект цитокинов зависит от их концентрации и взаимодействия с ингибиторами и активаторами. В ряде исследований пытались выявить корреляцию активности различных вариантов ювенильного ревматоидного артрита с динамикой определенных цитокинов. Результаты оказались неоднозначными. В большинстве работ было показано, что системный вариант заболевания коррелирует с повышением уровня растворимого рецептора ИЛ-2, а также ИЛ-6 и его растворимого рецептора, усиливающего активность самого цитокина и антагониста ИЛ-1, синтез которого стимулируется ИЛ-6. продуцирукция ИЛ-6 потенцируется также ФНО-α. Уровни растворимых рецепторов ФНО 1-го и 2-го типов были повышены и коррелировали с активностью системного ювенильного ревматоидного артрита.
В отличие от этого, у пациентов с пауциартикулярным ювенильным ревматоидным артритом и спондилоартропатией повышались преимущественно уровни ИЛ-4 и ИЛ-10, что ассоциируется с отсутствием значительных эрозивных изменений в суставах и соответственно с меньшей инвалидизацией пациентов, а также с более благоприятным исходом в отличие от полиартикулярного и системного ювенильного ревматоидного артрита.
Иммунопатогенез
Иммунопатогенез представлен на рисунке 1. Чужеродный антиген поглощается и перерабатывается антигенпрезентирующими клетками (дендритными, макрофагами и др.), которые в свою очередь презентируют его (или информацию о нем) Т-лимфоцитам. Взаимодействие антигенпрезентирующей клетки с CD4+-лимфоцитами стимулирует синтез ими соответствующих цитокинов. ИЛ-2, вырабатываемый при активации Th1, взаимодействует со специфическими ИЛ-2-рецепторами на различных клетках иммунной системы. Это вызывает клональную экспансию Т-лимфоцитов и стимулирует рост В-лимфоцитов, что приводит к массированному синтезу IgG плазматическими клетками, повышает активность естественных киллеров и активирует макрофаги. ИЛ-4, синтезируемый Th2-клетками, вызывает активацию гуморального звена иммунитета (проявляющуюся возрастающим нтезом антител), стимуляцию эозинофилов и тучных клеток, а также развитие аллергических реакций.
Активированные Т-лимфоциты, макрофаги, фибробласты и синовиоциты способны вырабатывать определенный набор противовоспалительных цитокинов, которые играют существенную роль в развитии системных проявлений и поддержании хронического воспаления в суставах.
Различные клинические и биологические проявления системного ювенильного ревматоидного артрита, включающие иммунопатологические реакции, воспаление, лихорадку, сыпь, артриты, лимфаденопатию, атрофию мышц, похудание, анемию, связывают в основном с повышенным синтезом и активностью ИЛ-1α и ИЛ-2β, ФНО-α и ИЛ-6. Провоспалительные цитокины определяют не только развитие экстраартикулярных проявлений, но и активность ревматоидного синовита.
Ревматоидный синовит имеет тенденцию к первично хроническому течению с последующей деструкцией мягких тканей, хряща и кости. Деструкция всех тканевых компонентов сустава вызывается формированием паннуса, включающего активированные макрофаги, фибробласты и активно пролиферирующие синовиальные клетки. Активированные макрофаги и синовиоциты продуцируют большое количество провоспалительных цитокинов: ИЛ-1, ФНО-α, ИЛ-8, гранулоцитарно-макрофагальный колониестимулирующий фактор, ИЛ-6. Провоспалительные цитокины играют ведущую роль в поддержании хронического воспаления и деструкции хряща и кости при ювенильном ревматоидном артрите. ИЛ-1 и ФНО-α стимулируют пролиферацию синовиоцитов и остеокластов, усиливают синтез простагландинов, коллагеназы и стромелизина клетками синовиальной мембраны, в частности ИЛ-6 и ИЛ-8. ИЛ-8 усиливает хемотаксис и активирует полиморфно-ядерные лейкоциты.
Этиологический фактор (неизвестен)
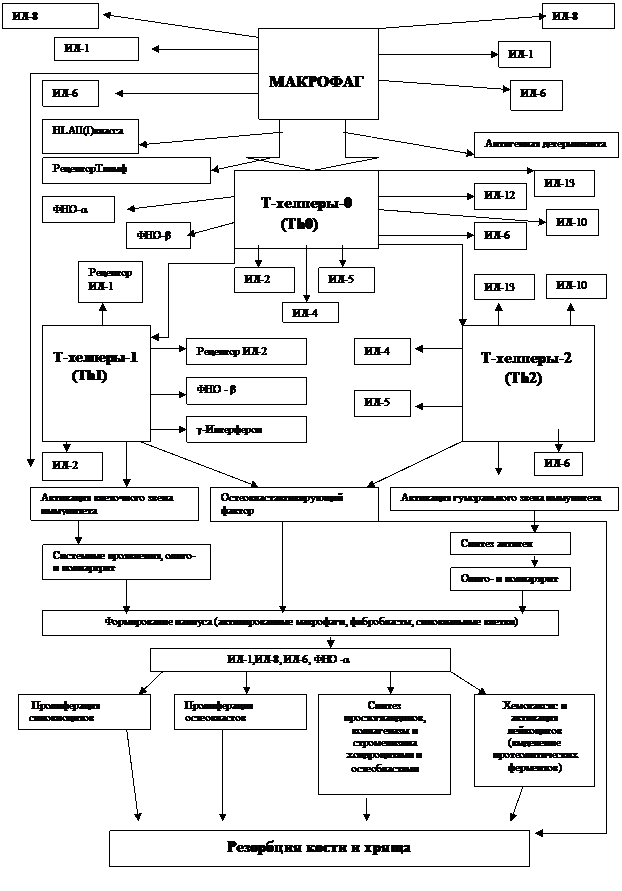

Рисунок1. Иммунопатогенез ювенильного ревматоидного артрита.
Активированные лейкоциты вырабатывают большое количество протеолитических ферментов, что усиливает резорбцию хряща и кости. При ювенильном ревматоидном артрите не только хрящ, но и кость может разрушаться на расстоянии от паннуса в связи с диффузией и системной выработкой цитокинов иммунокомпетентными клетками и синовиоцитами.
Т-лимфоциты, стимулированные в процессе иммунной реакции, вырабатывают остеокластактивирующий фактор, который повышает функцию остеокластов и тем самым увеличивает резорбцию кости. Выделение этого фактора усиливается под влиянием простагландинов. Их продукция при ювенильном ревматоидном артрите также значительно активируется клетками различных типов: макрофагами, нейтрофилами, синовиоцитами, хондроцитами.
Таким образом, самомодифицирующиеся реакции системы иммунобиологического надзора организма приводят к развитию хронического воспаления, необратимым изменениям в суставах, экстраартикулярным проявлениям, полиорганной недостаточности и к инвалидизации пациентов.
НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ. КОДЫ ПО МКБ-Х
В международной классификации болезней Х пересмотра (МКБ-10, 1990) впервые в отдельной рубрике – М08 – введен термин «ювенильный артрит». В этой же рубрике в качестве отдельных нозологических форм, имеющих собственные обозначения, представлено несколько отдельных заболеваний:
- М08 – Юношеский (ювенильный) артрит;
- М08.0 – Юношеский ревматоидный артрит;
- М08.1 – Юношеский анкилозирующий спондилит;
- М08.2 – Юношеский артрит с системным началом;
- М08.3 – Юношеский полиартрит (серонегативный);
- М08.4 – Пауциартикулярный юношеский артрит;
- М08.8 – Другие юношеские артриты.
В связи со значительной гетерогенностью РА у детей вопросы номенклатуры, классификации и нозологической диагностики ЮРА не нашли ещё своего окончательного и общепринятого решения. В течение длительного времени РА у взрослых и детей рассматривался как единая нозологическая форма, развивающаяся в различные периоды жизни. Многочисленные наблюдения отечественных и зарубежных исследователей (Шахбазян И.Е., 1983; Coss J.A. et al., 1946; Ansell B.M. et al., 1959; Bywaters E.G., 1968; Jacobs J.C., 1982; Kvien T.K. et al., 1982; Hoyeraal H.M., 1987) наглядно показали различия в клинической картине ЮРА и РА взрослых не только по частоте и качеству системных проявлений, но также и по характеру суставного синдрома.
Более того, генетические, иммунологические, клинические исследования последних лет подтверждают значительную гетерогенность ревматоидного артрита у детей. Отсутствие общепризнанных норм классификации и нозологической диагностики ЮРА, существование нескольких терминов для обозначения одного заболевания затрудняют решение медико-социальных проблем, выбора терапевтических программ для лечения этого заболевания, обмен научной информацией, интерпретацию результатов исследований и их сопоставление.
Дата добавления: 2018-06-01; просмотров: 418; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
