Глава 9. ЕКСПЕРИМЕНТАЛЬНІ ДАНІ ПРО БУДОВУ
ТА ВЛАСТИВОСТІ СКЛАДНИХ АТОМІВ
Структура атомів лужних металів, валентний електрон
Розрахунки енергетичної структури багатоелектронних атомів є складною задачею. Однак узагальненням властивостей атомів водню вдається пояснити основні властивості атомів лужних металів: літію  , натрію
, натрію  калію
калію  , рубідію
, рубідію  , цезію
, цезію  і францію
і францію  .
.
· Їх спектральні серії описуються узагальненою формулою Бальмера (4.10) з ефективним зарядом ядра  та приведеною масою
та приведеною масою 
 , (9.1)
, (9.1)
де  - стала Рідберга
- стала Рідберга  ,
,  - маса атомного ядра,
- маса атомного ядра,  - радіус першої борівської орбіти, а
- радіус першої борівської орбіти, а і
і  -квантові числа.
-квантові числа.
· Їх перші потенціали іонізації - малі, а другі та треті потенціали іонізації значно більші (таблиця 9.1)  .
.
Таблиця 9.1. Перші і другі енергії іонізації лужних металів
| H | Li | Na | K | Rb | Cs | |

| 13,6 | 5,37 | 5,12 | 4,32 | 4,16 | 3,88 |

| - | 121,9 | 71,3 | 31,45 | 27,14 | 23,3 |
· Вони одновалентні і утворюють сполуки:  тощо.
тощо.
Всі ці факти свідчать, що атоми лужних металів можна розглядати як воднеподібні атоми із одним валентнимелектроном, що знаходиться в кулонівському полі атомного ядра, екранованого сильно зв’язаними електронами (  .
.
Зняття виродження за квантовим числом l
| Рис.9.1. Схема збурення атомного остову валентним електроном. |
Стаціонарні стани валентного електрона в атомах лужних металів залежать від 3-х квантових чисел, як і в атомі водню:  але вони мають інші властивості з двох причин. По-перше, екранування атомного ядра сильно зв’язаними електронами змінює електричне поле в атомі, яке діє на зовнішній валентний електрон, що враховується ефективним зарядом ядра
але вони мають інші властивості з двох причин. По-перше, екранування атомного ядра сильно зв’язаними електронами змінює електричне поле в атомі, яке діє на зовнішній валентний електрон, що враховується ефективним зарядом ядра  По-друге, валентний електрон поляризує атомний остов, який складається з ядра і сильно зв’язаних електронів, створюючи з нього диполь, квадруполь тощо (рис.9.1), що також змінює внутрішньоатомне електричне поле в області руху валентного електрона. Потенціал внутрішньоатомного електричного поля такої збуреної системи атомного остову зручно навести у вигляді ряду
По-друге, валентний електрон поляризує атомний остов, який складається з ядра і сильно зв’язаних електронів, створюючи з нього диполь, квадруполь тощо (рис.9.1), що також змінює внутрішньоатомне електричне поле в області руху валентного електрона. Потенціал внутрішньоатомного електричного поля такої збуреної системи атомного остову зручно навести у вигляді ряду
|
|
|
 , (9.2)
, (9.2)
де  та
та 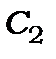 - розмірні коефіцієнти (
- розмірні коефіцієнти ( 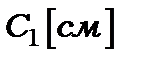 і
і  ). Перший член - дипольний, другий- квадрупольний і т.д.
). Перший член - дипольний, другий- квадрупольний і т.д.
 для
для 
Обмежившись дипольним членом, підставимо (9.2) у радіальну частину рівняння Шредінґера для стаціонарних станів, а кутова частина рівняння Шредінґера (8.14) залишається незмінною, бо до неї не входить 
 . (9.3)
. (9.3)
Введемо нове квантове число  за допомогою співвідношення
за допомогою співвідношення
 . (9.4)
. (9.4)
Із (9.4) знайдемо 
 (9.5)
(9.5)
 . (9.5*)
. (9.5*)
У (9.5*) використаний перед коренем квадратним знак плюс, бо  , тому знак мінус не має фізичного змісту.
, тому знак мінус не має фізичного змісту.
|
|
|
 , (9.6)
, (9.6)
де квантовий дефект  дорівнює
дорівнює
 . (9.7)
. (9.7)
Енергія стаціонарного стану для воднеподібних атомів визначається за формулою
 . (9.8)
. (9.8)
Підставивши значення  із (9.6) в (9.8) і використавши вираз (8.63) для головного квантового числа атома водню
із (9.6) в (9.8) і використавши вираз (8.63) для головного квантового числа атома водню  отримаємо:
отримаємо:
 (9.9)
(9.9)
Підставимо (9.9) у (9.8)
 (9.10)
(9.10)
або  , (9.11)
, (9.11)
де  (9.12)
(9.12)
Таким чином, виявляється, що енергія стаціонарних станів в атомах лужних металів залежить не тільки від головного квантового числа  але й від орбітального квантового числа
але й від орбітального квантового числа  , бо наявність екрануючих електронів та поляризації атомного остову створює внутрішнє поле в атомі, яке знімає виродження в атомах лужних металів.
, бо наявність екрануючих електронів та поляризації атомного остову створює внутрішнє поле в атомі, яке знімає виродження в атомах лужних металів.
Дата добавления: 2018-05-09; просмотров: 328; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
