Особливості тонкої структури атомних спектрів
Лужних металів
| Таблиця 9.3. Терми Na | |||
| n | l | j | терм |
| 3 | 0 | 1/2 | 32S1/2 |
| 1 | 1/2 | 32P1/2 | |
| 3/2 | 32P3/2 | ||
| 2 | 3/2 | 32D3/2 | |
| 5/2 | 32D5/2 | ||
| 4 | 0 | 1/2 | 42S1/2 |
| 1 | 1/2 | 42P1/2 | |
| 3/2 | 42P3/2 | ||
| 2 | 3/2 | 42D3/2 | |
| 5/2 | 42D5/2 | ||
| 3 | 5/2 | 42F5/2 | |
| 7/2 | 42F7/2 | ||
Розглянемо терми валентного електрона атомів лужних металів на прикладі атома Na з атомним номером 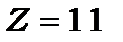 . Його валентний електрон знаходиться в не збудженому стані на енергетичному рівні з головним квантовим числом
. Його валентний електрон знаходиться в не збудженому стані на енергетичному рівні з головним квантовим числом 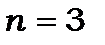 . Декілька його термів
. Декілька його термів
наведені в таблиці 9.3, де для їх характеристик використані стандартні позначення термів. Терми натрію мають бути дублетними, тому що 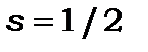 , мультиплетність термів дорівнює
, мультиплетність термів дорівнює 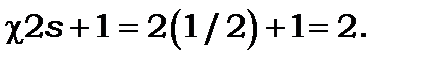 Між енергетичними рівнями можуть мати місце спонтанні переходи, якщо виконуються правила відбору. Застосування правила відбору для дипольних переходів
Між енергетичними рівнями можуть мати місце спонтанні переходи, якщо виконуються правила відбору. Застосування правила відбору для дипольних переходів 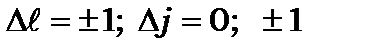 дозволило отримати такі спектральні серії (рис.9.7).
дозволило отримати такі спектральні серії (рис.9.7).
|
Рис.9.7. Схема термів і переходів між ними для атомів |
Головна серія (principal)
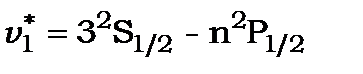
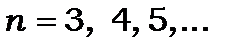
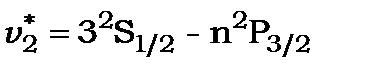
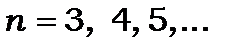 .
.
лінії цієї серії дублети, в яких 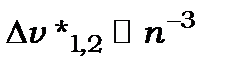 .
.
Друга побічна серія( sharp )
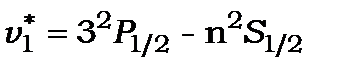 ,
, 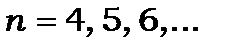
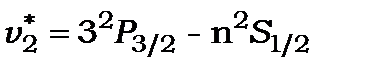 ,
, 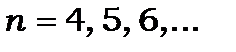
різниця хвильових чисел дублетів цієї серії не залежить від квантового числа 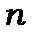 .
.
Дифузна серія (diffusion) або перша побічна
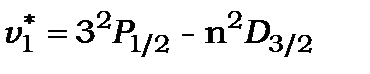
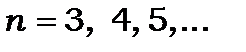
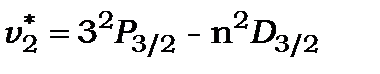
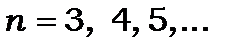
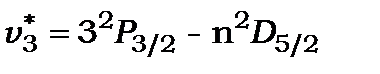
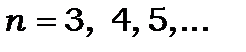
лінії цієї серії - триплети, у яких 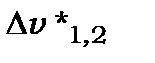 не залежить від квантового числа
не залежить від квантового числа 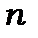 , а
, а 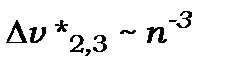 . Крім цих серій є ще фундаментальна серія ( рис. 9.7)
. Крім цих серій є ще фундаментальна серія ( рис. 9.7)
Таким чином, ми встановили мультиплетну структуру ліній основних серій спектрів атомів лужних металів і якісно вказали на залежність величини розщеплення лінії від головного квантового числа. Все це дає підставу стверджувати, що причиною виникнення тонкої структури термів і спектральних ліній атомних спектрів лужних металів є спін-орбітальна взаємодія. Під час розгляду складних багатоелектронних атомів потрібно враховувати обертальну складову енергії 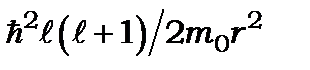 . Їх вплив призводить до появи залежності Е не тільки від n, але й від квантового числа
. Їх вплив призводить до появи залежності Е не тільки від n, але й від квантового числа  , тому можуть мати місце випадки, коли
, тому можуть мати місце випадки, коли 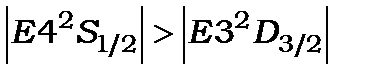 . Цей ефект збільшується пропорційно
. Цей ефект збільшується пропорційно 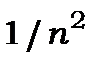 . Рівняння Шредінґера не дає кількісних величин розщеплення термів, бо воно не релятивістське, а в основі спін-орбітальної взаємодії лежить релятивістська магнітна взаємодія спінового і орбітального магнітних моментів. Для врахування магнітної взаємодії потрібно знайти нове фундаментальне рівняння, яке повинно бути інваріантним по відношенню до перетворень Лоренца. Таке рівняння було запропоновано нобелівським лауреатом Полем Діраком.
. Рівняння Шредінґера не дає кількісних величин розщеплення термів, бо воно не релятивістське, а в основі спін-орбітальної взаємодії лежить релятивістська магнітна взаємодія спінового і орбітального магнітних моментів. Для врахування магнітної взаємодії потрібно знайти нове фундаментальне рівняння, яке повинно бути інваріантним по відношенню до перетворень Лоренца. Таке рівняння було запропоновано нобелівським лауреатом Полем Діраком.
Розв’язок цього рівняння для найпростішого атома водню з урахуванням спін-орбітальної взаємодії дало величину енергії розщеплення термів, значення якої досить добре збігається з експериментальним. Воно виявилось прямо пропорційним квадрату сталої тонкої структури і квадрату атомного номера 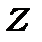 , та значенню
, та значенню 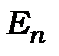
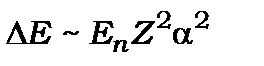 (9.32)
(9.32)
або точніше
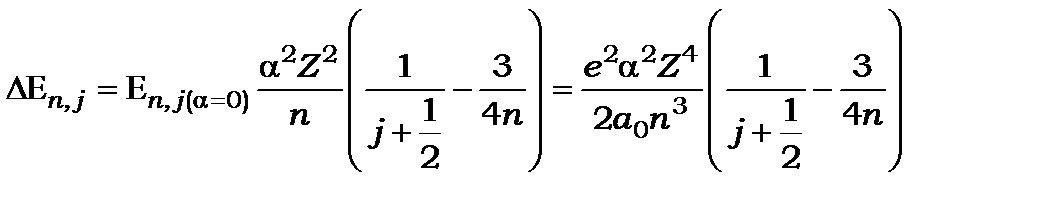 (9.33)
(9.33)
де 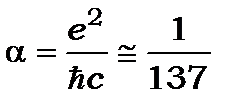 - стала тонкої структури, а
- стала тонкої структури, а 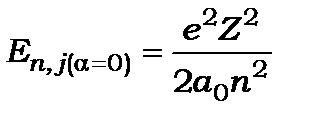 - енергія стаціонарного стану без врахування спін-орбітальної взаємодії. З формули (9.33) видно, що величина спін-орбітального розщеплення залежить лише від двох квантових чисел
- енергія стаціонарного стану без врахування спін-орбітальної взаємодії. З формули (9.33) видно, що величина спін-орбітального розщеплення залежить лише від двох квантових чисел 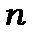 і
і 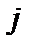 і не залежить для атома водню від орбітального квантового числа
і не залежить для атома водню від орбітального квантового числа  . Тому у атома водню зберігається виродження за орбітальним квантовим числом
. Тому у атома водню зберігається виродження за орбітальним квантовим числом  . При переході від атома водню до атомів лужних металів з одним валентним електроном виродження за числом
. При переході від атома водню до атомів лужних металів з одним валентним електроном виродження за числом  знімається, а величина розщеплення збільшується в
знімається, а величина розщеплення збільшується в 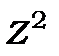 разів. Тому тонка структура спектрів, причиною виникнення якої є спін-орбітальна взаємодія, значно легше спостерігається в атомних спектрах лужних металів, ніж у атомному спектрі водню. Для спостереження за тонкою структурою спектрів атомів водню необхідно мати спектрограф з дуже великою роздільною здатністю такою, щоб
разів. Тому тонка структура спектрів, причиною виникнення якої є спін-орбітальна взаємодія, значно легше спостерігається в атомних спектрах лужних металів, ніж у атомному спектрі водню. Для спостереження за тонкою структурою спектрів атомів водню необхідно мати спектрограф з дуже великою роздільною здатністю такою, щоб 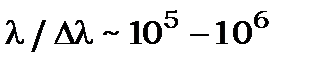 . Така тонка структура дійсно була знайдена і
. Така тонка структура дійсно була знайдена і 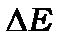 збільшувалось із збільшенням
збільшувалось із збільшенням 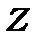 .
.
Дата добавления: 2018-05-09; просмотров: 399; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


 .
.