Глава 10. ТОНКА СТРУКТУРА АТОМНОГО СПЕКТРА ВОДНЮ
Тонка структура спектральних ліній атомного спектра водню. Спін-орбітальна взаємодія
Причиною появи тонкої структури термів  та спектральних ліній атомів водню є спін-орбітальна взаємодія. Енергії стаціонарних станів були отримані шляхом розв’язку рівняння Дірака (10.1). Вони залежать від двох квантових чисел: головного
та спектральних ліній атомів водню є спін-орбітальна взаємодія. Енергії стаціонарних станів були отримані шляхом розв’язку рівняння Дірака (10.1). Вони залежать від двох квантових чисел: головного  і числа
і числа 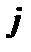 , яке визначає сумарний момент кількості руху електрона в атомі.
, яке визначає сумарний момент кількості руху електрона в атомі.
 , (10.1)
, (10.1)
де  - радіус першої борівської орбіти,
- радіус першої борівської орбіти,  – атомний номер, e і
– атомний номер, e і  – заряд і маса електрона відповідно,
– заряд і маса електрона відповідно,  - безрозмірна величина, яка складається із трьох головних констант фізики е,
- безрозмірна величина, яка складається із трьох головних констант фізики е,  і
і  , і називається сталою тонкої структури. Вона є однією з фізичних сталих, котрі характеризують електромагнітну взаємодію частинок. У формулі (10.1) вона характеризує спін-орбітальну взаємодію, внаслідок якої виникає тонка структура спектральних термів атома водню.
, і називається сталою тонкої структури. Вона є однією з фізичних сталих, котрі характеризують електромагнітну взаємодію частинок. У формулі (10.1) вона характеризує спін-орбітальну взаємодію, внаслідок якої виникає тонка структура спектральних термів атома водню.
З формули (10.1) видно, що терми атома водню вироджені за квантовим орбітальним числом  ,але виявляється вплив спін-орбітальної взаємодії, який враховується за допомогою квантового числа
,але виявляється вплив спін-орбітальної взаємодії, який враховується за допомогою квантового числа  сумарного орбітального моменту
сумарного орбітального моменту  . На схематичному рис.10.1 наведені терми та деякі переходи між ними:
. На схематичному рис.10.1 наведені терми та деякі переходи між ними:  , зсунуті згідно (10.1), на
, зсунуті згідно (10.1), на  ,
,  і
і  відповідно.
відповідно.
Правила відбору для дипольних переходів
 і
і 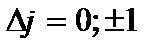 (10.2)
(10.2)
дають такі дублетні лінії спектральної серії Лаймана
|
Рис.10.1. Схема енергетичних рівнів атома водню з урахуванням спін-орбітальної взаємодії.
|
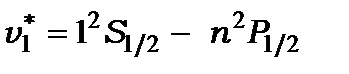

і квінтети для ліній серії Бальмера




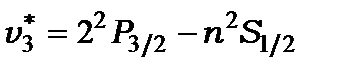





Крім того, з’являється ще одна шоста лінія  , котра знаходиться в радіодіапазоні довжин хвильз
, котра знаходиться в радіодіапазоні довжин хвильз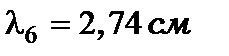
| Таблиця 10.1. Теоретичні та експериментальні дані для розщеплення рівнів | ||
| Розрахунок | Експеримент | |

| 10,956026 Ггц | 10,969127 ГГц |

| 44 10-6 еВ | 45 10-6 еВ |

| 0,364 см-1 | 0,361 см-1 |

| 2,74 см | 2,77 см |
Розрахунок за формулою Дірака (10.1) та експеримент дають значення  [25], і
[25], і  , котрі зведені в таблиці 10.1. Між розрахунком та експериментальними даними є певна розбіжність, яка дивувала фізиків. Вона хоча й не дуже велика, проте фізики докладали зусилля, щоб установити із чим вона пов’язана.
, котрі зведені в таблиці 10.1. Між розрахунком та експериментальними даними є певна розбіжність, яка дивувала фізиків. Вона хоча й не дуже велика, проте фізики докладали зусилля, щоб установити із чим вона пов’язана.
Надтонка структура ліній атомного спектра водню
Використання спектральних приладів ще більшої роздільної здатності дозволило встановити, що спектральні лінії атомного спектра водню (мають надтонку структуру  . Наприклад, дублет головної лінії серії Лаймана розщеплюється на 7 окремих складових (ліній).
. Наприклад, дублет головної лінії серії Лаймана розщеплюється на 7 окремих складових (ліній).
Для пояснення цієї надтонкої структури спектральних ліній не потрібно було використовувати нові гіпотези, бо для цього достатньо врахувати спін-ядерну взаємодію. З незалежних дослідів відомо, що спін протона дорівнює  . У цьому разі сумарний момент кількості руху
. У цьому разі сумарний момент кількості руху  буде векторною сумою сумарного спін-орбітального моменту електрона
буде векторною сумою сумарного спін-орбітального моменту електрона  , абсолютне значення якого залежить від квантового числа j, і спіном протона
, абсолютне значення якого залежить від квантового числа j, і спіном протона  абсолютне значення якого залежить від квантового числа
абсолютне значення якого залежить від квантового числа  :
:
|
|
|
 .
.
Абсолютна величина сумарного моменту  визначатиметьсяновим квантовим числом
визначатиметьсяновим квантовим числом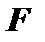 , яке знаходиться за допомогою правил складання моментів у квантовій механіці (глава 11). Воно дає таку нерівність для квантового числа
, яке знаходиться за допомогою правил складання моментів у квантовій механіці (глава 11). Воно дає таку нерівність для квантового числа 
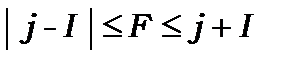
або для 

| Таблиця 10.2.
|
У таблиці 10.2 наведено приклад значень квантового числа F для трьох станів атома водню  . Кожному значенню квантового числа F повинен відповідати свій енергетичний рівень. На рис. 10.2 схематично зображено розщеплення термів атома водню з урахуванням впливу ядерного спіну.
. Кожному значенню квантового числа F повинен відповідати свій енергетичний рівень. На рис. 10.2 схематично зображено розщеплення термів атома водню з урахуванням впливу ядерного спіну.
Для знаходження ліній на рис.10.2 використані такі правила відбору
 , крім
, крім  .
.
Вони дозволяють отримати 7 окремих ліній, з яких складається дублет головної лінії серії Лаймана атомного спектру водню. Крім 7-ми складових оптичного діапазону (УФ) спектру,у радіодіапазоні в спектрах вбирання атомарного водню знаходять ще одну 8-му лінію з довжиною хвилі  .
.
|
|
|
|
Рис. 10.2. Схема рівнів з
 Мы поможем в написании ваших работ! |


 і
і 
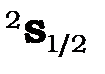

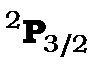

 атома водню з урахуванням спін-орбітальної та спін-ядерної взаємодій.
атома водню з урахуванням спін-орбітальної та спін-ядерної взаємодій.