Нормальний (L-S) або Рассел-Саундеровський зв’язок
Модель нормального зв’язку застосовується до легких атомів з невеликим значенням заряду ядра. В ній спочатку знаходять сумарний орбітальний момент кількості руху  і сумарний спіновий момент
і сумарний спіновий момент 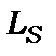 , а потім знаходять повний момент кількості руху
, а потім знаходять повний момент кількості руху 
 (11.3)
(11.3)
Оскільки орбітальні та спінові моменти електронів на заповнених оболонках дорівнюють нулю, то в (11.3) залишиться сума моментів електронів на не заповненій валентній оболонці. Абсолютні значення кутових моментів  визначаються новими квантовими числами: орбітальним
визначаються новими квантовими числами: орбітальним  , спіновим
, спіновим  і квантовим числом сумарного моменту кількості руху
і квантовим числом сумарного моменту кількості руху  за допомогою співвідношень:
за допомогою співвідношень:
 . (11.4)
. (11.4)
А їх проекції на довільну вісь  дорівнюють
дорівнюють
 . (11.5)
. (11.5)
 ,
,  ,
,  - магнітні квантові числа, значення яких залежать від квантових чисел
- магнітні квантові числа, значення яких залежать від квантових чисел  ,
,  і
і  .
.
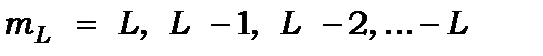 ,
,
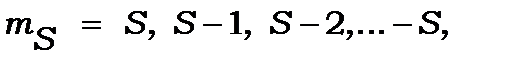
 (11.6)
(11.6)
Нагадаємо, що для атомів із декількома валентними електронами,  - квантове число сумарного орбітального моменту кількості руху електронів атома може мати лише цілі невід¢ємні значення, які відрізняються один від одного на одиницю і знаходяться в межах між максимальним і мінімальним значеннями їх суми
- квантове число сумарного орбітального моменту кількості руху електронів атома може мати лише цілі невід¢ємні значення, які відрізняються один від одного на одиницю і знаходяться в межах між максимальним і мінімальним значеннями їх суми  . Для двох електронів з квантовими числами
. Для двох електронів з квантовими числами  і
і 
 . (11.7*)
. (11.7*)
| Рис. 11.1. Нормальний (Рассел-Саундерса) зв’язок: а) - |
Для трьох електронів спочатку визначають  попереднім способом для двух електронів (11.7*), а потім аналогічно знаходять сумарний момент
попереднім способом для двух електронів (11.7*), а потім аналогічно знаходять сумарний момент  , що складається із моментів
, що складається із моментів 

|
|
|
 (11.7)
(11.7)
Цей розгляд продовжують до тих пір, поки не врахують усі Z електронів на зовнішній не заповненій оболонці атома.
Квантове число сумарного спіну  також має тільки невід¢ємні значення, що відрізняються одне від одного на одиницю і знаходяться між максимальним і мінімальним значеннями алгебраїчної суми
також має тільки невід¢ємні значення, що відрізняються одне від одного на одиницю і знаходяться між максимальним і мінімальним значеннями алгебраїчної суми 
 (11.8)
(11.8)
Квантове число  , яке характеризує сумарний кутовий момент
, яке характеризує сумарний кутовий момент  , набуває невід¢ємні значення, які відрізняються одне від одного на одиницю в межах
, набуває невід¢ємні значення, які відрізняються одне від одного на одиницю в межах
 (11.9)
(11.9)
Коли  , то
, то  набуває (
набуває (  ) значень, а коли
) значень, а коли  , то
, то  має (
має ( 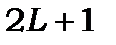 ) значень. При
) значень. При  , а при
, а при 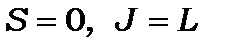 . Кількість можливих станів - значень квантового числа
. Кількість можливих станів - значень квантового числа  при даному значенні числа
при даному значенні числа  визначає мультиплетність термів (
визначає мультиплетність термів (  ) (див. табл. 11.1).
) (див. табл. 11.1).
| Таблиця 11.1 Мультиплетність залежно від квантового числа S | |||||
| 0 | ½ | 1 | 3/2 | 2 | |

| 1 | 2 | 3 | 4 | 5 |
| Мультиплетність | Синглет | дублет | Триплет | квартет | Квінтет |
Оскільки  , для окремого електрону, то із формули (11.8) видно, що при
, для окремого електрону, то із формули (11.8) видно, що при  непарних
непарних 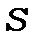 напівціле число, тобто мультиплетність парна (дублети, квартети тощо), а при
напівціле число, тобто мультиплетність парна (дублети, квартети тощо), а при  парних
парних 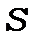 ціле число, тобто мультиплетність непарна (синглети, триплети, квінтети, тощо). Для
ціле число, тобто мультиплетність непарна (синглети, триплети, квінтети, тощо). Для  термів також вказують мультиплетність, проте ці терми є синглетними, оскільки в
термів також вказують мультиплетність, проте ці терми є синглетними, оскільки в  станах
станах  ) відсутня спін-орбітальна взаємодія.
) відсутня спін-орбітальна взаємодія.
|
|
|
Квантові числа складних атомів
Атоми характеризуються такими квантовими числами:  - головним,
- головним,  - орбітальним, що визначає абсолютну величину повного орбітального моменту кількості руху,
- орбітальним, що визначає абсолютну величину повного орбітального моменту кількості руху,  - повного спіну і
- повного спіну і  - повного моменту кількості руху (спінового і орбітального),
- повного моменту кількості руху (спінового і орбітального), 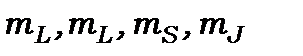 - магнітними квантовими числами сумарних орбітального, спінового і повного моментів кількості руху електрона в складному атомі відповідно. У відсутності силових полів енергетичний рівень визначається трьома квантовими числами
- магнітними квантовими числами сумарних орбітального, спінового і повного моментів кількості руху електрона в складному атомі відповідно. У відсутності силових полів енергетичний рівень визначається трьома квантовими числами  . Квантове число повного спіну
. Квантове число повного спіну  визначає мультиплетність термів за формулою
визначає мультиплетність термів за формулою  , а магнітні квантові числа визначають зміни енергії рівнів (енергетичне положенні термів) у присутності силових полів.
, а магнітні квантові числа визначають зміни енергії рівнів (енергетичне положенні термів) у присутності силових полів.
Для спектральних термів прийнято стандартне позначення:
 ,
,
| Таблиця 11.2. Символи термів
|
де для однозначності перед символами  , які позначаються великими латинськими літерами
, які позначаються великими латинськими літерами  (табл. 11.2) виписують символи малими латинськими буквами, які характеризують електронну конфігурацію даного атома. Мультиплетність
(табл. 11.2) виписують символи малими латинськими буквами, які характеризують електронну конфігурацію даного атома. Мультиплетність  ставлять ліворуч зверху біля символу
ставлять ліворуч зверху біля символу  , а внизу праворуч ставлять число
, а внизу праворуч ставлять число 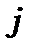 .
.
|
|
|
Наприклад 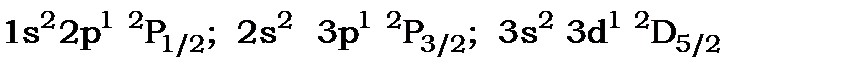 тощо.
тощо.
Правила відбору
Правила відбору вказують, які із можливих переходів між енергетичними рівнями в атомі дозволені, а які заборонені, у вигляді відповідних змін квантових чисел при переходах. Вони зв’язані з симетрією квантових систем, тобто з незмінністю (інваріантністю) їх властивостей при певних перетвореннях координат і часу, і відповідними законами збереження. Переходи з порушенням законів збереження енергії, імпульсу, моментів кількості руху тощо у замкнених системах виключаються. Правила відбору в атомі визначають через ненульові матричні елементи оператора взаємодії дипольного моменту системи або більш складного квадрупольного моменту системи „атом плюс поле” в процесах випромінювання та поглинання світла. Тому розрізняють правила відбору для дипольних і квадрупольних спонтанних переходів.
Раніше для спонтанних дипольних переходів у одноелектронних атомів ми отримали такі правила відбору:
|
|
|
 (11.10)
(11.10)
У багатоелектронних атомів, до яких можна застосувати модель нормального  зв’язку, спонтанні дипольні переходи відбуваються, коли виконуються такі правила відбору:
зв’язку, спонтанні дипольні переходи відбуваються, коли виконуються такі правила відбору:
 (11.10*)
(11.10*)
У легких атомів найбільш імовірні переходи, для яких сумарне спінове число не змінюється  (правило інтеркомбінаційної заборони).В атомах важких елементів можливі інтеркомбінаційні переходи, для яких
(правило інтеркомбінаційної заборони).В атомах важких елементів можливі інтеркомбінаційні переходи, для яких  . Крім того, коли між електронами в атомі має місце сильна взаємодія й можуть збуджуватися більше одного електрона, то з’являється ще одне правило відбору для дипольних переходів:
. Крім того, коли між електронами в атомі має місце сильна взаємодія й можуть збуджуватися більше одного електрона, то з’являється ще одне правило відбору для дипольних переходів:
 . (10.10**)
. (10.10**)
Однак, ці переходи відбуваються досить рідко. Для квадрупольних переходів з’являються додаткові правила відбору: 
Правила Хунда (Гунда)
Векторна модель не дає енергетичної послідовності термів. Для визначення найбільш глибоких рівнів енергій користуються трьома емпіричними правилами Хунда (Гунда).
Перше правило Хунда. Для даної електронної конфігурації терми з більшою мультиплетністю мають більші абсолютні значення енергій:
 для
для  (11.11)
(11.11)
Наприклад, триплетні терми на енергетичних діаграмах, де енергія зв’язаного електрона  , знаходяться нижче, ніж дублетні чи синглетні терми.
, знаходяться нижче, ніж дублетні чи синглетні терми.
Друге правило Хунда. Для даної електронної конфігурації та мультиплетності, тобто при заданих  і
і  , основні терми атомів з більшими значеннями сумарного орбітального числа
, основні терми атомів з більшими значеннями сумарного орбітального числа  мають більші за абсолютною величиною енергії, ніж терми з меншими значеннями
мають більші за абсолютною величиною енергії, ніж терми з меншими значеннями  :
:
 для
для  (11.12)
(11.12)
Третє правило Хунда. Для даної електронної конфігурації при заданих значеннях квантових чисел  ,
,  і
і  чим менше квантове число J, тим більша за абсолютною величиною енергія терма:
чим менше квантове число J, тим більша за абсолютною величиною енергія терма:
 для
для  (11.13)
(11.13)
Така ієрархія має місце у випадку, коли валентна електрона оболонка заповнена наполовину, тобто на ній знаходиться електронів менше ніж  . У випадку, коли електронна оболонка заповнена більше, як на половину, тобто, коли на ній знаходиться електронів більше, ніж
. У випадку, коли електронна оболонка заповнена більше, як на половину, тобто, коли на ній знаходиться електронів більше, ніж  , то в (11.13) змінюється знак нерівності на протилежний і терми заглиблюються із збільшенням квантового числа
, то в (11.13) змінюється знак нерівності на протилежний і терми заглиблюються із збільшенням квантового числа  на енергетичних діаграмах,
на енергетичних діаграмах, 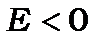 ,
, 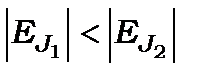 для
для  .
.
Перші два правила засновані на врахуванні електростатичної взаємодії електронів, а третє - на врахуванні магнітної взаємодії.
Перше правило пояснюється детальними розрахунками обмінної взаємодії, які показують, що в атомі більшої мультиплетності, наприклад, триплетному, електронний розподіл виявляється більш стиснутим, ніж в атомі меншої мультиплетності, наприклад, синглетному, що підсилює притяжіння електронів до ядра. Воно компенсує відштовхування між електронами з однаково направленими спінами і дає виграш в енергії атомів з паралельними спінами по відношенню до атомів з антипаралельними спінами.
Друге правило відображає здатність електронів уникати один одного, якщо орбітальні моменти примушують їх рухатись в одному напрямку. Електронам, що рухаються в одному напрямку, простіше залишатись віддаленими один від одного, що зменшує кулонівське відштовхування. Якщо електрони рухаються в різних напрямках, то вони більш часто зустрічаються, і тому середня відстань між ними менша, а кулонівське відштовхування більше.
Третє правило відображає спін-орбітальну взаємодію, яка буде меншою при протилежно направлених магнітних моментах орбітального і спінового.
Правило Гунда в основному добре працює для визначення основних термів (найнижчих по енергії) для атомів, для яких справедливий  звязок. Для атомів для яких справедливий
звязок. Для атомів для яких справедливий  зв’язок правило Гунда може давати не вірні результати.
зв’язок правило Гунда може давати не вірні результати.
11.6. Систематика спектрів складних атомів з нормальним зв’язком
Мета систематики терміві спектрів складних атомів – це встановлення структури термів та спектральних ліній – визначення їх мультиплетності та енергетичної (частотної) ієрархії. Вона складається з таких етапів.
По-перше, користуючись принципом Паулі, який дає правило заповнення електронних атомних оболонок (глава 13), визначають електронну конфігурацію атома – розподіл електронів на оболонках.
По-друге, за допомогою векторної моделі визначають квантові числа електронів  валентної оболонки атома. Для обрахунку максимального сумарного орбітального квантового числа
валентної оболонки атома. Для обрахунку максимального сумарного орбітального квантового числа  , потрібно брати суму всіх орбітальних чисел електронів на незаповненій електронній оболонці
, потрібно брати суму всіх орбітальних чисел електронів на незаповненій електронній оболонці  . Сума дає вірні результати, коли електронна конфігурація не має еквівалентних електронів.
. Сума дає вірні результати, коли електронна конфігурація не має еквівалентних електронів.
Еквівалентні електрони - це електрони з однаковими квантовими числами  і
і  . Їхня максимальна кількість дорівнює кількості можливих станів
. Їхня максимальна кількість дорівнює кількості можливих станів  . Тому заповнені оболонки мають електронні конфігурації:
. Тому заповнені оболонки мають електронні конфігурації:  . Еквівалентні електрони заповненої оболонки мають нульові моменти кількості руху
. Еквівалентні електрони заповненої оболонки мають нульові моменти кількості руху  . Оболонка заповнюється так: спочатку електрони заповнюють
. Оболонка заповнюється так: спочатку електрони заповнюють  станів з різними магнітними квантовими числами
станів з різними магнітними квантовими числами  ,
,  ,
,  …,
…,  при однаковому квантовому числі
при однаковому квантовому числі  , а потім
, а потім 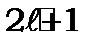 станів із спіновим магнітним числом
станів із спіновим магнітним числом  . Наприклад, оболонка p має
. Наприклад, оболонка p має  = 6 станів (p6). Спочатку на ній заповнюються стани з
= 6 станів (p6). Спочатку на ній заповнюються стани з  з проекцією спіну
з проекцією спіну  : px, py , pz - конфігурації
: px, py , pz - конфігурації  відповідно. Потім починають заповнюватись стани з протилежно направленою проекцією спіну
відповідно. Потім починають заповнюватись стани з протилежно направленою проекцією спіну  : px¯, py, pz - конфігурація
: px¯, py, pz - конфігурація  , після цього конфігурація p5 (px, py¯, pz) і потім конфігурація p6 (px¯, py¯, pz ¯).
, після цього конфігурація p5 (px, py¯, pz) і потім конфігурація p6 (px¯, py¯, pz ¯).
Емпірично встановлено, що стан N еквівалентних електронів коли  , еквівалентний стану з електронами в кількості
, еквівалентний стану з електронами в кількості
 (11.14)
(11.14)
Наведемо приклад еквівалентних електронів. Конфігурація  еквівалентна конфігурації
еквівалентна конфігурації  ; конфігурація
; конфігурація  еквівалентна конфігурації
еквівалентна конфігурації 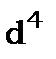 ; конфігурація
; конфігурація  еквівалентна конфігурації
еквівалентна конфігурації  ,тощо.
,тощо.
По-третє, за допомогою квантового числа сумарного спіну S встановлюється мультиплетність термів за формулою  . Максимальне значення числа S знаходиться як сума спінових чисел окремих електронів
. Максимальне значення числа S знаходиться як сума спінових чисел окремих електронів  , де
, де  . Для парних
. Для парних  максимальне спінове число дорівнює
максимальне спінове число дорівнює  тому мультиплетність термів буде непарною, бо
тому мультиплетність термів буде непарною, бо  , і навпаки - для непарних
, і навпаки - для непарних  мультиплетність буде парною, бо
мультиплетність буде парною, бо  . Таблиця 11.3 ілюструє цю властивість термів.
. Таблиця 11.3 ілюструє цю властивість термів.
| Таблиця 11.3. Мультиплетність термів атомів з різними (нормальні та збуджені конфігурації) | |||||

| 1 | 2 | 3 | 4 | 5 |
| елемент | 
| 
| 
| 
| 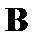
|

| ½ | ¯ 0 | ¯ 1/2 | ¯¯ 0 | ¯¯ 1/2 |
| - | 1 | ¯ 1 | ¯ 3/2 | ||

| 2 - | 1 3 | 2 | 1 3 | 2 4 |
| мультиплетність | дублет - | синглет триплет | дублет | синглет триплет | дублет квартет |
Вона дозволяє знаходити терми для парних та непарних 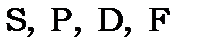 мультиплетних термів для кожної трійки квантових чисел
мультиплетних термів для кожної трійки квантових чисел  як це наведено у таблиці 11.4. Методика знаходження термів для еквівалентних електронів описані, наприклад, в задачнику [1] та підручнику [6].
як це наведено у таблиці 11.4. Методика знаходження термів для еквівалентних електронів описані, наприклад, в задачнику [1] та підручнику [6].
| Таблиця 11.4. Терми різних мультиплетностей | |||||||||||
| | c дублети | ||||||||||

| 0 | 1 | 2 | 3 | 4 | 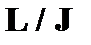
| 1/2 | 3/2 | 5/2 | 7/2 | 9/2 |
| 0 | 1S0 | 2S1/2 | |||||||||
| 1 | 1P1 | 2P1/2 | 2P3/2 | ||||||||
| 2 | 1D2 | 2D3/2 | 2D5/2 | ||||||||
| 3 | 1F3 | 2F5/2 | 2F7/2 | ||||||||
| 4 | 1G4 | 2G7/2 | 2G9/2 | ||||||||
| | | ||||||||||

| 0 | 1 | 2 | 3 | 4 | 
| 1/2 | 3/2 | 5/2 | 7/2 | 9/2 |
| 0 | 3S1 | 0 | 4S3/2 | ||||||||
| 1 | 3P0 | 3P1 | 3P2 | 1 | 4P1/2 | 4P3/2 | 4P5/2 | ||||
| 2 | 3D1 | 3D2 | 3D3 | 2 | 4D1/2 | 4D3/2 | 4D5/2 | 4D7/2 | |||
| 3 | 3F2 | 3F3 | 3F4 | 3 | 4F3/2 | 4F5/2 | 4F7/2 | 4F9/2 | |||
Дата добавления: 2018-05-09; просмотров: 766; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 , б) -
, б) -  , в) -
, в) - 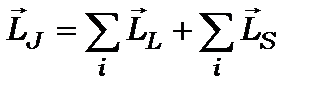 .
.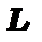








 ¯ синглети
¯ синглети триплети
триплети квартети
квартети