Приклади застосування векторної моделі атома
Наведемо приклади застосування векторної моделі атома з нормальним (рассел-саундеровським) зв¢язком.
(1)Атом водню Н. Атом водню ми вже розглядали з використанням векторної моделі. Його сумарне спінове число 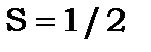 , тому терми дублетні. Лінії серії Лаймана також дублетні, а лінії серії Бальмера більш складні. Головна лінія складається із 5 ліній у видимій області спектра і однієї лінії в радіо діапазоні.
, тому терми дублетні. Лінії серії Лаймана також дублетні, а лінії серії Бальмера більш складні. Головна лінія складається із 5 ліній у видимій області спектра і однієї лінії в радіо діапазоні.
(2) Атом гелію He з  має два електрона зі спіновими квантовими числами
має два електрона зі спіновими квантовими числами 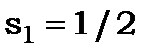 і
і  . Сумарне спінове число має значення
. Сумарне спінове число має значення  , тобто
, тобто  . Отже, гелій має дві системи термів: для
. Отже, гелій має дві системи термів: для  ;
;  - синглети, адля
- синглети, адля  ;
;  - триплети. Спочатку вважали, що гелій складається з двох типів атомів. Частина атомів Не з антипаралельними спінами, що мають синглетні терми, отримала назву парагелію, а друга їх частина з паралельними спінами, що мають триплетні терми, називається ортогелієм. Це звичайно не так, тому що дві системи термів характерні для одного атома, але історично збереглася термінологія для позначення системи термів (парагелій, ортогелій).
- триплети. Спочатку вважали, що гелій складається з двох типів атомів. Частина атомів Не з антипаралельними спінами, що мають синглетні терми, отримала назву парагелію, а друга їх частина з паралельними спінами, що мають триплетні терми, називається ортогелієм. Це звичайно не так, тому що дві системи термів характерні для одного атома, але історично збереглася термінологія для позначення системи термів (парагелій, ортогелій).
Розглянемо електронну конфігурацію і терми атому гелію. Врахуємо, що за принципом Паулі в стані  можуть знаходитись два електрони лише з антипаралельними спінами, і тому для основної конфігурації існує тільки синглетний терм. Нехай один електрон завжди залишається в стані
можуть знаходитись два електрони лише з антипаралельними спінами, і тому для основної конфігурації існує тільки синглетний терм. Нехай один електрон завжди залишається в стані  , а другий знаходиться у різних станах. Для конфігурації
, а другий знаходиться у різних станах. Для конфігурації  ,
,  можуть існувати стани з паралельними та антипаралельними спінами, тобто будуть синглетні та триплетні терми. У таблиці 11.5 наведені терми для парагелію
можуть існувати стани з паралельними та антипаралельними спінами, тобто будуть синглетні та триплетні терми. У таблиці 11.5 наведені терми для парагелію  та ортогелію
та ортогелію  На рис.11.2 приведена схема термів для гелію. Звернемо увагу, що порядок рівнів для гелію
На рис.11.2 приведена схема термів для гелію. Звернемо увагу, що порядок рівнів для гелію  є оберненим, тобто рівні з більшим внутрішнім числом
є оберненим, тобто рівні з більшим внутрішнім числом  лежать нижче. Це пояснюється теоретично, якщо врахувати спін-орбітальну і спін-спінову взаємодію двох електронів між собою.
лежать нижче. Це пояснюється теоретично, якщо врахувати спін-орбітальну і спін-спінову взаємодію двох електронів між собою.
|
|
|
| Таблиця 11.5. Терми пара- і ортогелію | |||||||||
| парагелій | Ортогелій | ||||||||
|
|
| ||||||||
| терм | конфігурація | Терм | конфігурація | ||||||
| L | J | 1-й | 2-й | L | J | 1-й | 2-й | ||
| 1S0 | 0 | 0 | 1s1 | 1s1 | - | - | 1s1 | - | |
| 1S0 | 0 | 0 | 2s2 | 3S1 | 0 | 1 | 1s1 | ||
| 1P1 | 1 | 1 | 2p1 | 3P2,1,0 | 1 | 2,1,0 | 2p1 | ||
| 1S0 | 0 | 3s1 | 3S1 | 0 | 1 | 3s1 | |||
| 1P1 | 1 | 3p1 | 3P2,1,0 | 1 | 2,1,0 | 3p1 | |||
| 1D2 | 2 | 3d1 | 3D3,2,1 | 2 | 3,2,1 | 3d1 | |||
| 1S0 | 0 | 4s1 | 3S1 | 0 | 1 | 4s1 | |||
| 1F3 | 3 | 4f1 | 3F4,3,2 | 3 | 4,3,2 | 4f1 | |||
Правила відбору для дипольних переходів  дозволяють знайти спектральні серії атома Не, які наведні на рис.11.2 і в таблиці 11.6.
дозволяють знайти спектральні серії атома Не, які наведні на рис.11.2 і в таблиці 11.6.
|
|
|
Синглетні лінії (головна серія) лежать в далекій ультрафіолетовій області спектра (500-600 А°), синглетні спектральні лінії різкої серії - в видимому та ближньому УФ діапазоні. Синглетні спектральні лінії дифузної та фундаментальної серій в видимому та інфрачервоному областях спектра. Серії триплетних ліній – в ІЧ, УФ, та видимому діапазонах. Триплетна структура ліній дуже вузька, і для дослідження цієї структури необхідні прилади досить високої дисперсії та роздільної здатності. Перша лінія триплетної серії 
 була знайдена в спектрі протуберанців Сонця в 1868р, що привело до відкриття гелію.
була знайдена в спектрі протуберанців Сонця в 1868р, що привело до відкриття гелію.

Рис.11.2. Схема термів атома гелію.
| Таблиця 11.6. Квантові переходи та серії атома гелію | |
| Парагелій | Ортогелій |
| u* = 11S0 - n1P1 | Головна серія (principal) u*1 = 23S1 - n3P0 u*2 = 23S1 - n3P1 Du*~ n-3 u*3 = 23S1 - n3P2 триплети |
| u* = 21P1 - n1S0 | Різка (sharp) друга побічна серія u*1 = 23P0 - n3S1 u*2 = 23P1 - n3S1 Du*¹f(n) u*3 = 23P1 - n3S1 триплети |
| u* =21P1 - n1D2 | Дифузна(diffusion)перша побічна серія u*1 = 23P0 - n3D1 Du*12¹f(n) u*2 = 23P1 - n3D1 Du*23¹f(n) u*3 = 23P1 - n3D2 u*4 = 23P2 - n3D1 секстети u*5 = 23P2 - n3D2 u*6 = 23P2 - n3D3 |
| u* = 31D2 - n1F3 | Фундаментальна (fundamental) серія u*1 = 33D1 - n3F2 Du*12¹f(n) u*2 = 33D2 - n3F2 Du*23 ~n-3 u*3 = 33D2 - n3F3 Du*34 ~n-3 u*4 = 33D3 - n3F2 Du*45 ~n-3 u*5 = 33D3 - n3F3 u*6 = 33D3 - n3F4 секстети |
Парагелій не має в незбудженому стані магнітного моменту  , а ортогелій має
, а ортогелій має  тому атом гелію – діамагнітний в стані парагелію, а в стані ортогелію - парамагнітний.
тому атом гелію – діамагнітний в стані парагелію, а в стані ортогелію - парамагнітний.
|
|
|
Атом гелію має також метастабільні рівні та
та переходи з яких на основний рівень 1S0 заборонені правилами відбору
переходи з яких на основний рівень 1S0 заборонені правилами відбору 
 . Експериментально встановлено, що метастабільні стани Не мають досить великі енергії та великий час життя.
. Експериментально встановлено, що метастабільні стани Не мають досить великі енергії та великий час життя.
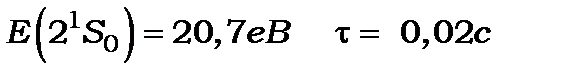
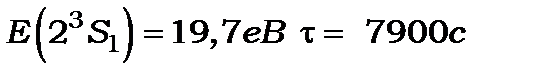
Ці дані використовувуються на практиці.
Наприклад, якщо електрони розсіюються на збуджених до метастабільного стану атомах гелію Не*, то вони передають свою енергію збудження електрону, що розсіюється. Розсіяний електрон збільшує кінетичну енергію, що може бути зареєстровано. Зіткнення, при яких потенціальна енергія збудження перетворюється в кінетичну, називаються зіткненнями другого роду.
 . (11.15)
. (11.15)
На практиці для зменшення напруги запалювання електричного розряду в газах як корисну домішку до робочого "тіла” гелій- неонового лазера використовують атоми Не*,збуджених на метастабільний рівень
|
|
|
(3)Пара- і орто- позитроній. Позитроній може мати сумарне спінове число  при антипаралельних спінах електрона і позитрона і
при антипаралельних спінах електрона і позитрона і  при паралельних спінах електрона і позитрона. Тому позитроній має два стани пара- і орто- з
при паралельних спінах електрона і позитрона. Тому позитроній має два стани пара- і орто- з  або з
або з 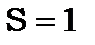 . Парапозитроній має синглетні терми і синглетні лінії. Він не має магнітного моменту в не збудженому стані і тому він діамагнітний. Ортопозитроній має триплетні терми і магнітний момент, що не дорівнює нулю.
. Парапозитроній має синглетні терми і синглетні лінії. Він не має магнітного моменту в не збудженому стані і тому він діамагнітний. Ортопозитроній має триплетні терми і магнітний момент, що не дорівнює нулю.
(4)ЛітійLi  має електронну конфігурацію
має електронну конфігурацію  . Сумарне спінове число
. Сумарне спінове число  . Його терми дублетні:
. Його терми дублетні:  ;
;  ;
;  ;
;  ;
;  , тощо. Схема подібних термів на прикладі атомів натрію вже розглядалась раніше (глава 9).
, тощо. Схема подібних термів на прикладі атомів натрію вже розглядалась раніше (глава 9).
(5)Берилій Be  має електронну конфігурацію в незбудженому стані 1s2¯2s2¯. У випадку коли спіни антипаралельні
має електронну конфігурацію в незбудженому стані 1s2¯2s2¯. У випадку коли спіни антипаралельні  , і основним термом атома берилію є
, і основним термом атома берилію є  . Для збуджених електронних конфігурацій атом берилію може мати синглетні терми:
. Для збуджених електронних конфігурацій атом берилію може мати синглетні терми:


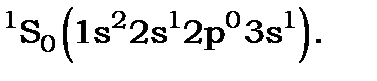
У другому випадку коли збуджений атом берилію має сумарне спінове число  , будемо мати триплетні терми:
, будемо мати триплетні терми:




Детально енергетичні стани берилію представлені в таблиці 11.7.
| Таблиця 11.7. Енергетичні стани берилію | ||
| Електронна конфігурація | Синглетні 
| Триплетні 
|
| 1s22s2 (2p0) ¯ ¯ | 1S0 | |
| 1s22s12p1 ¯ ¯ | 1P1 | |
| ¯ | 3P03P13P2 | |
| 1s22s1(2p0)3s1 ¯ ¯ | 1S0 | 3S1 |
| 1s22s1(2p03s0)3p1 ¯ ¯ | 1P1 | |
| ¯ | 3P03P13P2 | |
| 1s22s1(…3s03p0)3d1 ¯ ¯ | 1D2 | |
| ¯ | 3D13D23D3 | |
| 1s22s1 (... 3d 0)3f1 ¯ ¯ | 1F3 | |
| ¯ | 3 F23F33F4 | |
(6)Вуглець C  має електронну конфігурацію в незбудженому стані
має електронну конфігурацію в незбудженому стані  . Значення квантового числа сумарного орбітального моменту кількості руху
. Значення квантового числа сумарного орбітального моменту кількості руху  бо
бо  і
і 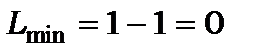 . У залежності від електронної конфігурації С може мати стани з різними сумарними спіновими числами, як наведено в таблиці 11.8. (дивись задачу №5, розділ 9 [1].
. У залежності від електронної конфігурації С може мати стани з різними сумарними спіновими числами, як наведено в таблиці 11.8. (дивись задачу №5, розділ 9 [1].
| Таблиця 11.8. Енергетичні стани вуглецю | ||
| Електронна конфігурація | Триплетні терми 
| Синглетні терми 
|
| 1s22s22p2 | ||
| ¯ ¯ | 3P0; 3P1; 3P2 | |
| ¯ ¯ ¯ | 1S0; 1D2 | |
| 1s22s22p13s1 | ||
| ¯ ¯ | 3P0; 3P1; 3P2 | |
| ¯ ¯ ¯ | 1P1 | |
| 1s22s2(2p13s0)3p1 ¯ | 3P0; 3P1; 3P2;3S1; 3D1; 3D2;3D3 | |
| ¯ ¯ | 1S0; 1P1; 1D2 | |
| 1s22s2 (2p3p0)3d1 ¯ | 3P0; 3P1; 3P2; 3D1;3D2;3D3; 3F2;3F3;3F4 | |
| ¯ ¯ | 1P1; 1D2 ;1F3 | |
(7) ФторF.  . Електронна конфігурація
. Електронна конфігурація  у не збудженому стані
у не збудженому стані 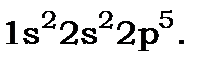 . Видно, що необхідно перейти до розгляду еквівалентного електрона в стані
. Видно, що необхідно перейти до розгляду еквівалентного електрона в стані  У цьому разі
У цьому разі  . Отже терми фтору дублетні:
. Отже терми фтору дублетні:  .
.
J-J зв’язок
 зв’язок менш поширений ніж
зв’язок менш поширений ніж  (нормальний) зв’язок. Він застосовується для класифікації термів важких атомів (з великими Z). Енергія взаємодії орбітальних і спінових моментів у випадку
(нормальний) зв’язок. Він застосовується для класифікації термів важких атомів (з великими Z). Енергія взаємодії орбітальних і спінових моментів у випадку  зв’язку менша за енергію спін-орбітальної взаємодії
зв’язку менша за енергію спін-орбітальної взаємодії
 (11.16)
(11.16)
| Рис. 11.3. б) - |
Тому в цій моделі спочатку знаходять сумарний вектор спінового та орбітального моментів кількості руху для кожного електрона атома
 , (11.17)
, (11.17)
а потім знаходять сумарний вектор повного моменту кількості руху всіх електронів.
 , (11.18)
, (11.18)
де  - нове квантове число, яке визначає абсолютну величину сумарного моменту кількості руху. Воно може бути знайдене за допомогою співвідношення
- нове квантове число, яке визначає абсолютну величину сумарного моменту кількості руху. Воно може бути знайдене за допомогою співвідношення
 , (11.19)
, (11.19)
деостанній член суми повинен бути найменшим значенням по модулю при комбінації чисел  . Символічний запис терма при
. Символічний запис терма при  зв'язку
зв'язку  .
.
Кількість можливих значень квантового числа  не залежить від типу зв’язку. Це твердження виникає внаслідок, так званого, принципу адіабатичної інваріантності. У випадку
не залежить від типу зв’язку. Це твердження виникає внаслідок, так званого, принципу адіабатичної інваріантності. У випадку  та
та  зв’язків можна пересвідчитись, що максимальні значення числа
зв’язків можна пересвідчитись, що максимальні значення числа  для них збігаються.
для них збігаються.
Дійсно,  для
для 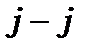 зв’язку, а для
зв’язку, а для  зв’язку
зв’язку  .
.
Розглянемо прикладsp- стану, коли 
(а) Спочатку знайдемо квантові числа  для 1-го і 2-го електронів:
для 1-го і 2-го електронів:
1) - для першого електрону  , тому що
, тому що 
2) для другого електрону 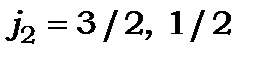 , тому що
, тому що 
(б) Потім знайдемо значення квантових чисел  , які визначаються нерівністю
, які визначаються нерівністю

для двох станів: одного при  і другого при
і другого при 
Для першого стану  .
.
Для другого стану  .
.
|
Рис.11.4 Схема термів
|
Таким чином, утворилося 4 окремих стани з різними квантовими числами:  . Їх кількість така, як і у випадку нормального
. Їх кількість така, як і у випадку нормального 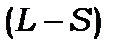 зв’язку, для якого в
зв’язку, для якого в  стані сумарне спінове число
стані сумарне спінове число  має два значення - 0 і 1, а орбітальне
має два значення - 0 і 1, а орбітальне 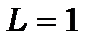 , тобто утворюється чотири терма для нормального типу зв’язку
, тобто утворюється чотири терма для нормального типу зв’язку 
Вони наведені на рис.11.4 ліворуч: один синглетний рівень –  і три триплетних
і три триплетних  Більш глибокими будуть триплетні стани з паралельними спінами.
Більш глибокими будуть триплетні стани з паралельними спінами.
У середній частині рис.11.4 наведено чотири терма, що попарно групуються  і
і  . Із них терми
. Із них терми 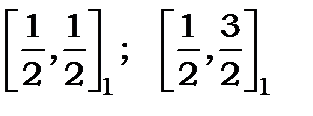 - синглетні, бо число
- синглетні, бо число  можна отримати, коли спіни антипаралельні
можна отримати, коли спіни антипаралельні 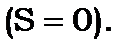 Дійсно
Дійсно  , коли
, коли 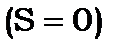 , а терми
, а терми  - триплетні, бо коли
- триплетні, бо коли  , можна отримати
, можна отримати  і 2
і 2  . Дозволені переходи між окремими термами визначаються правилами відбору для квантових чисел:
. Дозволені переходи між окремими термами визначаються правилами відбору для квантових чисел:
 .
.
Кількість термів, як вже вказувалося, не залежить від вибору моделі, тому спочатку у нульовому наближенні використовують для систематики термів нормальний зв’язок, а потім при розгляді важких елементів переходять до використання  зв'язку. Вибір моделі змінює правило інтервалів, інтенсивності ліній та їх поведінку у зовнішніх полях. У випадку
зв'язку. Вибір моделі змінює правило інтервалів, інтенсивності ліній та їх поведінку у зовнішніх полях. У випадку  зв’язку рівні з меншими
зв’язку рівні з меншими  розташовані глибше рівнів з більшими
розташовані глибше рівнів з більшими 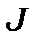 , тоді як у випадку
, тоді як у випадку 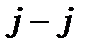 зв'язку це правило порушується, як це видно на рис.11.4.
зв'язку це правило порушується, як це видно на рис.11.4.
Висновки
1. Векторна модель використовується для систематизації (класифікації) термів і спектральних ліній багатоелектронних атомів – аналізу їх мультиплетності та структури. Вона заснована на використанні правил векторного складання моментів окремих електронів для одержання сумарного кутового моменту електронів атома.
2. Оскільки оператори квадрата кутового моменту 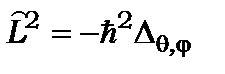 і його проекції
і його проекції  не залежать від потенціалу атома
не залежать від потенціалу атома  то це спрощує аналіз багатоелектронних атомів, зводячи його до алгебраїчної комбінаторики квантових чисел, яка визначає всі комбінації спінових та орбітальних внесків у повний кутовий момент атома.
то це спрощує аналіз багатоелектронних атомів, зводячи його до алгебраїчної комбінаторики квантових чисел, яка визначає всі комбінації спінових та орбітальних внесків у повний кутовий момент атома.
3. Енергія електронів у атомі визначається його електронною конфігурацією, яка знаходиться за допомогою принципу виключення Паулі (глави 14 і 15).
4. Векторна модель обмежується розглядом електронів, що знаходяться на зовнішніх, незаповнених оболонках атома, бо на повністю заповнених оболонках вони мають нульові кутові моменти.
5. Коли валентна оболонка заповнена більш, ніж на половину, то для визначення сумарного кутового моменту використовують еквівалентні електрони, кількість яких  ) менша реальної кількості електронів
) менша реальної кількості електронів 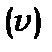 , бо
, бо  ,
,
6. Квантові числа сумарних кутових моментів використовуються для позначення термів атомів (електронна конфігурація +  ).
).
7. Послідовність складання окремих кутових моментів впливає на сумарний кутовий момент. На практиці використовують два граничних випадки зв’язків між моментами:  (нормального або зв’язку Рассел-Саундерса) і
(нормального або зв’язку Рассел-Саундерса) і  зв’язку. Нажаль, жоден з цих граничних випадків не дає точного уявлення про справжнє положення справ, тому прийнято застосовувати модель нормального
зв’язку. Нажаль, жоден з цих граничних випадків не дає точного уявлення про справжнє положення справ, тому прийнято застосовувати модель нормального  зв’язку до легких атомів, а
зв’язку до легких атомів, а  зв’язок використовувати, головним чином, для аналізу важких атомів.
зв’язок використовувати, головним чином, для аналізу важких атомів.
8. Кількість термів не залежить від типу зв’язку, але сильно впливає на правило інтервалів (послідовність термів у залежності від квантового числа  ), відносні інтенсивності ліній, їх поведінку у зовнішніх полях.
), відносні інтенсивності ліній, їх поведінку у зовнішніх полях.
9. Правило відбору квантових чисел дозволяє аналізувати структуру ліній спектральних серій.
10. Основні терми атомів, для яких характерний  зв’язок визначається за допомогою емпіричних правил Хунда (Гунда).
зв’язок визначається за допомогою емпіричних правил Хунда (Гунда).
АТОМ ГЕЛІЮ
Дата добавления: 2018-05-09; просмотров: 603; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 ¯ синглети
¯ синглети триплети
триплети зв’язок: а) -
зв’язок: а) -  ,
, , в) -
, в) -  .
.
 стану для
стану для  і
і  зв’язків, з якої видно, що кількість станів не залежить від типу зв¢язку.
зв’язків, з якої видно, що кількість станів не залежить від типу зв¢язку.