Стерилізація поживних середовищ и посуду
Стерилізація - один з важливих і необхідних прийомів в мікробіологічній техніці. Під стерилізацією (від лат. «sterilis» - знепліднення) в мікробіології розуміють загибель всіх живих мікроорганізмів. У мікробіологічній практиці стерилізують поживні середовища, посуд, інструмент та інші необхідні матеріали з метою уникнення розвитку сторонньої мікрофлори.
Існують різні методи стерилізації: фізичний, механічний і хімічний. Доцільність застосування кожного з них визначається особливостями матеріалу, предмета стерилізації, його фізичнимивластивостями, хімічним складом, метою дослідження.
Фізичний метод стерилізації (стерилізація нагріванням) найчастіше застосовується в мікробіологічній практиці.
Стерилізація пропалюванням над полум'ям пальника. Цим способом стерилізують дрібні лабораторні інструменти, препарувальні голки, бактеріологічні петлі, скляні палички, пінцети тощо.
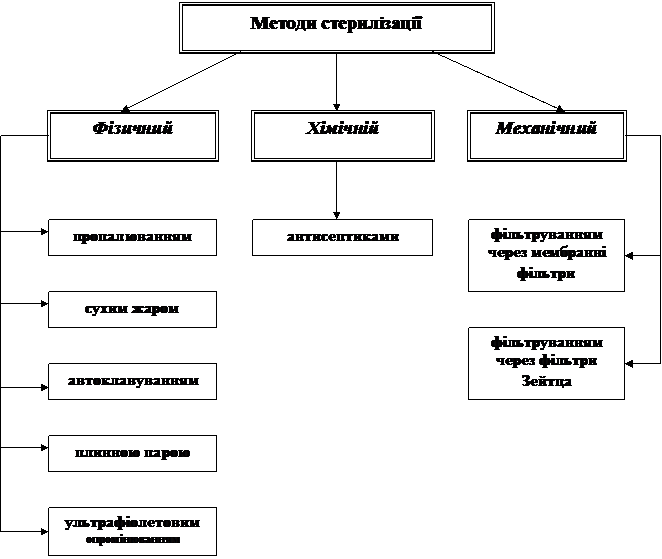
Стерилізація сухим жаром проводиться в електросушильній шафі. Сухим жаром стерилізують скляний посуд - піпетки, чашки Петрі, пробірки, шпателі, загорнуті в паперові серветки. Стерилізація в сушильних шафах здійснюється при 165-180°С протягом 2 г.
Стерилізація автоклавуванням застосовується, головним чином, для стерилізації живильних середовищ. Цей спосіб оснований на обробці насиченою парою під тиском, вищим за атмосферний, тобто при температурі понад 100°С. Використовують додатковий до атмосферного тиск у 0,5, 1 і 2 атм (кПа), при цьому температура пари підвищується відповідно до 112, 121 і 134°С. Сумісна дія високої температури і пари забезпечує знищення як вегетативних, так і спорових форм мікроорганізмів за достатньо короткий термін.
|
|
|
Стерилізація здійснюється в спеціальних апаратах - автоклавах. Автоклав це металевий двостінний котел, який здатний витримувати високий тиск. Між стінками, тобто у водопарову камеру, через лійку заливають воду до необхідного рівня. Ця камера має кран для виходу повітря і пари. Внутрішня частина котла — це стерилізаційна камера, куди поміщають матеріал для стерилізації. Кришка автоклава герметично закривається гвинтами (рис. 11).

Рисунок 11 - Схема автоклава:
1 - стерилізаційна камера; 2 - кран для виходу повітря; 3 – манометр; 4 – запо-біжний клапан; 5 - водопарова камера; 6 - лійка; 7 - отвори для надходження пари до стерилізаційної камери; 8 - кришка автоклава; 9 - підставка для розміщення матеріалів, які стерилізуються
Після розміщення матеріалів у стерилізаційній камері і герметичного закривання кришки автоклав вмикають в електричну мережу. Нагрівач підігріває воду, доводить її до кипіння і пара, яка утворилася, витісняє повітря зі стерилізаційної камери. Коли все повітря витіснено перекривають кран і пара починає піднімати тиск до заданого. Коли стрілка манометру досягає потрібного тиску, фіксують час початку стерилізації. В сучасних конструкціях автоклавів підтримка заданого тиску відбувається автоматично. По закінченні терміну стерилізації (найчастіше 30 хв) нагрівання припиняють (вимикають з електромережі) і чекають поки не спаде тиск (стрілка манометра падає до 0). Після цього відкривають кран, випускають пару, а після повного охолодження автоклаву відкривають кришку.
|
|
|
Режим автоклавування (температура і термін стерилізації) визначається складом поживного середовища. Наприклад, середовища, які містять цукри, вітаміни (пивне сусло), деякі білкові середовища (желатинове молоко) автоклавують при додатковому тиску 0,5 кПа (112°С) протягом 20-30 хв, м'ясо-пептонні середовища - при 1 кПа (121°С) 20-30 хв.
Стерилізація плинною парою застосовується для середовищ, що містять речовини, які змінюються під дією температури вище 100°С. Таку стерилізацію проводять в автоклаві з|із| кришкою, що не загвинтили, при відкритому|відчиняти| крані| для випуску пари або спеціальному апараті.
|
|
|
Плинною парою проводять роздрібнену стерилізацію, яка проводиться при 100°С протягом 3-х днів по 30-40 хв щодня. В проміжках між стерилізацією поживні середовища залишають при 18-20°С або витримують в термостаті для того, щоб спори, що залишилися після кип'ятіння, могли прорости у вегетативні клітки, які гинуть при наступному|такому| нагріванні.
Плинною парою проводять також пастеризацію і тиндалізацію. Пастеризація – ще неповна стерилізація, проводиться нагріванням до 50-60°С 15-30 мін або до 70-80°С 5-10 мін з подальшим охолодженням до 10-11°С. Застосовується для інактивації вегетативних клітин мікроорганізмів в рідинах, що не витримують високу температуру|: (молоко, пиво, соки і т. п.). Оскільки при пастеризації спорові форми виживають, для того, щоб спори не проросли, пастеризовані продукти зберігаються на холоді.
Тиндалізація - подрібнена пастеризація, яка здійснюється декілька разів (6-7 днів) з перервою в 24 г, коли матеріал, що стерилізується, витримують при 18-20°С для проростання спор у вегетативні клітини, які знищуються при подальшій пастеризації.
Стерилізація ультрафіолетовим опромінюванням. Дія ультрафіолетових променів знаходить широке використання для стерилізації повітря в лабораторних приміщеннях, в цехах промислових підприємств. Для знезараження повітря використовують бактерицидні лампи. У зв’язку з можливої несприятливою дією ультрафіолетових променів на організм людини бактерицидні лампи вмикають тільки при відсутності людей в приміщенні.
|
|
|
Хімічний метод стерилізації застосовують при дезинфекції. Дезинфекція - це спосіб знищення мікроорганізмів за допомогою сильнодіючих речовин або так званих антисептиків.
До групи антисептиків відносяться неорганічні та органічні речовини. Із неорганічних антисептиків широко використовуються неорганічні кислоти, луги та солі (0,1-0,2% розчини сулеми), хлорне вапно 10-20%, йод. Із органічних речовин застосовують етиловий і бутиловий спирти, альдегіди, органічні кислоти та розчинники (3-5% розчин фенолу, 0,2-0,5% розчин хлораміну і 1-4% розчин формаліну). В лабораторній практиці методи дезінфекції використовують для знезараження поверхні робочого столу, рук, боксів для посіву.
Механічний метод стерилізації застосовується в тих випадках, коли субстрати не витримують нагрівання і дії хімічних речовин (білки, сироватки, антибіотики, вітаміни та ін.).
Стерилізація фільтруванням за допомогою мембранних фільтрів. Мембранні фільтри виготовляють з коллодію, ацетату целюлози та інших матеріалів у вигляді дисків товщиною біля 0,1мм, діаметром 35 мм. Залежно від розміру пор (0,35, 0,5, 0,7, 0,9 і 1,2 мкм) вони позначаються відповідно № 1, 2, 3, 4 і 5. Для стерилізації необхідно використовувати фільтр № 1.
Стерилізація фільтруванням за допомогою фільтра Зейтца. (тверді диски, виготовлені з азбесту з целюлозою). Рідина, яка стерилізується - всмоктується через стерильний фільтр у стерильну колбу, в якій за допомогою насосу утворюється вакуум. Мікроорганізми осідають у порах фільтру.
Завдання:
1. Вивчити класифікацію поживних середовищ. Визначити фактори, за якими відбувається вибір поживного середовища залежно від мети дослідження.
2. Ознайомитися з методами і режимами стерилізації поживних середовищ і посуду. Вивчити будову і принцип дії автоклава в мікробіологічній лабораторії.
3. Приготувати МПА: до 1 л м’ясної води (або бульйону) додати 5 г кухонної солі, 10 г пептону і 20 г агар-агару, розплавити на електроплиті, розлити в чашки Петрі, простерилізувати.
Питання для самоконтролю:
1. Які умови необхідні для розвитку мікроорганізмів?
2. Як класифікують поживні середовища?
2. Чим відрізняються природні поживні середовища від синтетичних?
4. Що таке елективні середовища?
5. Чим відрізняються елективні середовища від диференційно-діагностичних?
6. Як класифікують поживні середовища за фізичним станом?
7. Яке стандартне поживне середовище використовують для визначення кількості МАФАМ?
8. Які елективні поживні середовища застосовують для виявлення бактерій групи кишкової палички (БГКП)?
9. Які середовища використовують для вирощування дріжджів та плісеневих грибів?
10. Яку речовину найчастіше додають до рідких середовищ, щоб утворились тверді і чому?
11. Що являє собою агар-агар?
12.Що являє собою желатин?
13. Що таке стерилізація?
14. Які є методи стерилізації?
15. Які Ви знаєте фізичні методи стерилізації?
16.Який режим стерилізації застосовується для посуду?
17.Який метод стерилізації застосовують для дрібних металевих предметів: бактеріологічні петлі, препарувальні голки, трафарети тощо?
18.Чи вважається об'єкт стерильним, якщо всі вегетативні клітини знищені, а спори залишились?
19.Яким чином стерилізують поживні середовища плинною парою в автоклаві?
20.Що таке пастеризація і тиндалізація?
21.Які Ви знаєте органічні та неорганічні антисептики?
22.Що таке механічна стерилізація?
ЛАБОРАТОРНА РОБОТА № 7
Дата добавления: 2018-04-05; просмотров: 3123; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
