Дослід 3. ДОБУВАННЯ ЙОДОФОРМУ ЗI СПИРТУ
У пробірку наливають 1 мл води, 0,5 мл етилового спирту і 3–4 мл розчину йоду в йодиді калію. В цю суміш по краплях додають 10 %-ний розчин гідроксиду натрію до зникнення бурого забарвлення. Через деякий час спостерігається поява жовтого осаду йодоформу, що легко розпізнається за характерним запахом. Реакція проходить за схемою:
взаємодія йоду з лугом:
J2 + NaOH → Н20 + NaJ + NaOJ;
окислення спирту в альдегід:

заміна атомів Гідрогену в залишку оцтового альдегіду на галоген:
СH3-CHO + 3 J2 + NaOH → CJ3-CHO + 3NaJ + 3H2O;
розщеплення трийодоцтового альдегіду при наявності лугу:
CJ3-CHO + NaOH → CHJ3 + H-COONa.
Сумарне рівняння має такий вигляд:
CH3-CH2OH + 4J2 + 6NaOH → CHJ3 + H-COONa + 5NaJ + 5Н2О.
Дослід 4. ЗАМІЩЕННЯ ГАЛОГЕНУ НА ГІДРОКСИЛ ПІД ДІЄЮ ЛУГУ У пробірку до 0,5 мл хлороформу приливають 2–3 мл 10 %-ного розчину гідроксиду натрію й обережно при збовтуванні нагрівають суміш до кипіння. Потім охолоджують, відстоюють і зливають частину водно-лужного шару. До цієї частини обережно добавляють нітратну кислоту до кислого середовища (проба на лакмус) і кілька крапель 1 % -ного розчину нітрату аргентуму.
При цьому утворюється білий осад хлориду аргентуму, не розчинний у нітратній кислоті:


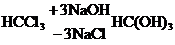 H–COOH;
H–COOH;
H-COOH + NaOH → H-COONa + H2O;
NaCl + AgNO3 → AgCl ¯+ NaNO3.
За однакової будови галогенопохідних легкість заміни галогену понижується в ряду J>Br>Cl>F.
Дослід 5. РЕЗОРЦИНОВА ПРОБА
|
|
|
НА ХЛОРОФОРМ, БРОМОФОРМ ТА ЙОДОФОРМ
Характерною якісною реакцією на хлороформ, бромоформ і йодоформ є так звана, резорцинова проба.
У пробірку наливають 1–2 мл свіжо приготовленого 10 % -ного розчину резорцину, кілька крапель 10 %-ного розчину гідроксиду натрію і кілька крапель хлороформу або кристаликів йодоформу. Суміш нагрівають. З'являється забарвлення.
Дослід 6. ПОРІВНЯННЯ РУХЛИВОСТІ АТОМІВ ГАЛОГЕНУ У БЕНЗЕНОВОМУ КІЛЬЦІ ТА У БОКОВОМУ ЛАНЦЮЗІ
Атоми галогенів, що перебувають у бензеновому кільці, мало рухливі. Вони переважно вступають у реакцію обміну на відміну від атомів галогену, які перебувають у боковому ланцюзі.
Стійкість галогену в бензеновому кільці. У пробірку набирають кілька крапель бромбензену або хлоробензену, добавляють 2–3 мл 1 %-ного водного розчину нітриту аргентуму і нагрівають. Утворення осаду броміду або хлориду аргентуму не спостерігається, що свідчить про важку заміну атома галогену, безпосередньо з'єднаного з бензеновим ядром.
В умовах цього досліду реакція гідролізу бромбензену або хлоробензену не відбувається.
Рухливість галогену в боковому ланцюзі. У невеликий циліндр із притертою пробкою вміщують кілька крапель хлористого бензилу і добавляють 5–8 мл 2 %-ного водно-спиртового розчину нітрату аргентуму. Циліндр закривають пробкою. При енергійному збовтуванні спочатку спостерігається помутніння розчину, а потім з'являється осад хлориду аргентуму, кількість якого збільшується під час слабкого нагрівання. Це вказує на легкість заміни атома хлору, що перебуває в боковому ланцюзі. Реакція проходить за таким рівнянням:
|
|
|

Примітка. Залишок хлористого бензилу і посуд, в якому він знаходився, треба обробити розчином гідроксиду натрію, оскільки хлористий бензил с лакриматором і подразнює слизову оболонку.
Дослід із хлористим бензиліденом. У пробірку наливають хлористого бензилідену і 4 мл 10 %-ного спиртового розчину гідроксиду калію.
Вміст пробірки нагрівають на водяній бані при температурі 70-80 °С протягом 5 хв. Хлористий бензиліден у цих умовах піддається гідролізу й утворює бензеновий альдегід із характерним запахом гіркого мигдалю:
 Контрольні запитання
Контрольні запитання
- Запропонуйте схеми синтезу: хлористого етилу, фтористого пропілу, йодистого етилу, ізопропілброміду.
- Зазначте основні напрямки використання галогенпохідних в будівництві, сільському господарстві, в медицині та ін. Наведіть приклади.
Дата добавления: 2018-04-05; просмотров: 720; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
