Дослід 9. СУБЛІМАЦІЯ НАФТАЛЕНУ
У суху пробірку вносять кілька шматочків нафталену і закріплюють її на штативі. Обгорнувши верхню половину пробірки вологим фільтрувальним папером, починають обережно нагрівати дно. У верхній частині пробірки утворюються кристали нафталену.
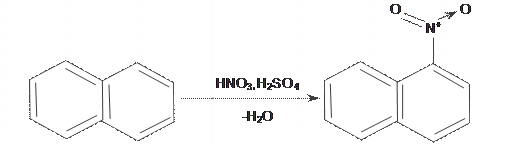
Дослід 10. НІТРУВАННЯ НАФТАЛЕНУ
У суху пробірку наливають 3–5 мл концентрованої нітратної кислоти і поступово додають 0,5 г попередньо розтертого у фарфоровій ступці нафталену. Реакційну суміш весь час енергійно перемішують, нагрівають протягом 2–3 хв. на киплячій бані і через деякий час виливають у хімічну склянку з 25–30 мл води. Випадають жовті кристали α-нітронафталену:
Дослід 11. БРОМУВАННЯ НАФТАЛЕНУ
У суху пробірку вносять кілька кристалів нафталену, приливають чотири краплі брому й енергійно струшують вміст пробірки. Нафтален поступово розчиняється і бромується на холоді, доказом чому є зникнення забарвлення брому й виділення бульбашок бромовою, що димить на повітрі.
У другу пробірку вносять таку саму кількість нафталіну і брому, і нагрівають пробірку до кипіння. Бромування нафталену відбувається значно швидше:

Дослід 12. СУЛЬФУВАННЯ НАФТАЛЕНУ
Невелику кількість розтертого нафталену обережно нагрівають на водяній бані протягом 10–15 хв. у пробірці з 2–3 мл концентрованої сульфатної кислоти. Нафтален розчиняється, утворюючи α-нафталенсульфокислоту:
|
|
|
Вміст пробірки охолоджують і виливають у хімічну склянку з 15– 20 мл води. Одержують прозорий розчин, оскільки α-нафталенсульфокислота добре розчиняється у воді.

Контрольні запитання
1.Напишіть структурні формули ізомерів гомологів бензену з молекулярною формулою С9Н12. Укажіть їх назви.
2. Розмістіть наведені нижче сполуки у порядку зменшення їх реакційної здатності у реакції нітрування та напишіть ці реакції:
а) бензен, бромобензен, толуен, нітробензен
б) хлоробензен, п-хлоронітробензен, 2,4-динітрохлоробензен
ГАЛОГЕНОПОХІДНІ ВУГЛЕВОДНІВ
Галогенопохідні аліфатичних вуглеводнів розглядають як похідні, вуглеводнів, у яких один або кілька атомів Гідрогену заміщені на атоми галогенів. Залежно від кількості заміщених атомів Гідрогену розрізняють моно-, ди-, три- і полігалогенопохідні. Галогенопохідні класифікують також за типом галогену, який входить до складу молекули: флуоро-, хлоро-, бромо-і йодопохідні. Залежно від типу вуглеводню, похідним якого є галогенопохідна сполука, розрізняють галогенопохідні насичених, ненасичених і ароматичних вуглеводнів.
Насичені моногалогенопохідні (галогеналкани) мають загальну формулу CnH2n+1Hal, де Hal – галоген. Ізомерія галогенопохідних залежить від ізомерії карбонового ланцюгу, а також положення галогену. Залежно від типу атома Карбону, з яким з'єднаний галоген, розрізняють: первинні, вторинні, третинні галогенопохідні.
|
|
|
За тривіальною номенклатурою моногалогенопохідні називають за назвою залишків, що входять до складу молекул й, з добавкою слова "галоген", звідси — галогеналкани.
Галогенопохідні рідко зустрічаються у природі, їх, як правило, синтезують, для найчастіше використовують реакцію заміщення Гідрогену в насичених вуглеводнях або гідроксильної групи у спиртах, або реакцію приєднання галогену або галогеноводню до ненасичених вуглеводнів.
Фізичні й хімічні властивості галогеналканів залежать від хімічної природи галогену та будови залишку.
У молекулах галогеналканів атоми галогену з'єднані ковалентним зв'язком. Вони не утворюють іонів, і галогени неможливо визначити реакцією з нітратом аргентуму. І все ж таки галогенопохідні є дуже реакційно здатними речовинами. Вони легко замінюють атом галогену на інші атоми або групи їх, оскільки ковалентний зв'язок між атомом Карбону галогену поляризований:
|
|
|

Міцність ковалентного зв'язку різних галогенопохідних неоднакова залежить від будови вуглеводневого залишку і хімічної природи галогену. Між'ядерні відстані C-HaI в ряду C-Cl, C-Br, C-J збільшуються, енергія зв'язку падає, спорідненість до електронів зменшується. Ці фактори впливають на ступінь поляризації зв'язку й зумовлюють різну рухомість галогенів. Найбільшою рухомістю володіє йод, меншою – бром, і найменшою - хлор. Найхарактернішою реакцією для них є взаємодія з нуклеофільними реагентами.
Галогенопохідні легко реагують із Гідрогеном, галогеноводнями, водою, водними й спиртовими розчинами лугів, амоніаком, ціанідом калію, алкоголятами, солями карбонових кислот, нітратом аргентуму, багатьма металами. При цьому утворюються вуглеводні, спирти, аміни, етери й естери, нітрили.
Лабораторна робота № 6
Дата добавления: 2018-04-05; просмотров: 966; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
