III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность. 14 страница

В зависимости от того, о каких концентрациях идет речь, титр может измеряться в граммах, миллиграммах, нанограммах в одном литре, или миллилитре раствора (г/л, мг/л, нг/л, нг/мл).
Как видно, для пересчета одой концентрации в другую очень часто возникает необходимость знать плотность раствора, что – бы можно было перейти от массы к объему. Плотности водных растворов различных веществ зависят от количества растворенного вещества и занесены в справочники в виде т.н. таблиц плотностей.
Теперь, когда мы можем охарактеризовать количественный состав различных растворов можно обсудить их типы. Растворы, в зависимости от концентрации растворенного вещества делятся на концентрированные, разбавленные.
· Концентрированные растворы содержат более 1 моль растворенного вещества в 1 литре (C > 1моль/л)
· Разбавленные растворы содержат менее 1 моль растворенного вещества в 1 литре (C < 1моль/л)
Иногда встречается устаревший термин крепкий раствор. Этот термин является современником Д.И. Менделеева, и в силу несовершенства методов анализа тех лет, в общем-то, не понятно, о растворе какой концентрации идет речь [37]. Так – же в курсе физической химии используется термин предельно разбавленные растворы. В предельно разбавленных растворах концентрация вещества настолько мала, что взаимодействием частиц растворенного вещества можно пренебречь.
Как уже было указано выше, при добавлении новых порций растворенного вещества в раствор может наступить состояние насыщения – новые порции вещества перестанут растворяться. Это состояние является равновесным, частицы растворенного вещества постоянно осаждаются на границе между раствором и кристаллом и растворяются с его поверхности. Так как состояние равновесное, то скорости этих процессов равны. Скорость растворения вещества равна скорости его осаждения. Концентрация насыщенного раствора при постоянных условиях называется его растворимостью. Если вещество обладает высокой растворимостью в данном растворителе, то оно называется растворимым. Если растворимость очень низка, то такое вещество называется нерастворимым. Хотя, строго говоря, любое вещество будет растворяться в любом растворителе, вопрос лишь в интенсивности протекания этого процесса. Абсолютно нерастворимых веществ не существует. Растворимость зависит от природы вещества и растворителя и внешних факторов: температуры и давления.
|
|
|
Влияние природы отражается эмпирическим правилом: подобное растворяется в подобном. Под подобием имеется в виду тип химической связи. Полярные вещества (с ковалентной полярной или ионной связью) будут хорошо растворяться в полярных растворителях (вода, аммиак, низшие спирты) и плохо в неполярных растворителях (керосин, бензол, эфиры). И наоборот, неполярные вещества хорошо растворяются в бензоле и керосине, а в воде – плохо.
|
|
|
Влияние давления и температуры определяется принципом Ле Шателье. Если при растворении вещества выделяется тепло, то повышение температуры уменьшит растворимость, а уменьшение температуры её увеличит, и наоборот для тех веществ, которые при растворении тепло поглощают. Давление влияет на растворимость газов в жидкостях и твердых телах, чем выше давление, тем выше будет растворимость газа.
Итак, в зависимости от того, какова концентрация раствора по отношению к растворимости вещества выделяют три типа растворов:
1) Ненасыщенный раствор – это раствор, концентрация растворенного вещества в котором меньше растворимости при данных условиях. Добавление новых порций вещества приведет к их растворению. Равновесие «растворение – осаждение» смещено в сторону процесса растворения.
2) Насыщенный раствор – это раствор, концентрация растворенного вещества в котором равна растворимости при данных условиях. Добавление новых порций вещества не приведет к их растворению. Термодинамическая система «раствор – осадок» находится в равновесии.
|
|
|
3) Пересыщенный раствор – это раствор, концентрация растворенного вещества в котором выше растворимости при данных условиях. Такие растворы нестабильны, их ΔG образования положительна. Избыток вещества может легко выпасть в осадок даже от перемешивания. Они готовятся в условиях, когда растворимость вещества повышена (например, при повышенной температуре), а затем насыщенный в этих условиях раствор осторожно переводится к требуемым условиям (например, охлаждается до комнатной температуры).
Теперь поговорим о природе процесса растворения. В школе на уроках физики и химии не раз повторялось, что процесс растворения является физико-химическим, его природа двойственная. Современная теория растворения создана на основе двух предшественниц – физической и химической теорий растворения:
· С точки зрения физической теории процесс растворения – это распределение частиц растворенного вещества между частицами растворителя, предполагая отсутствие какого-либо взаимодействия между ними. Единственной движущей силой такого процесса является увеличение энтропии системы ΔS; какие-либо тепловые или объемные эффекты при растворении отсутствуют (ΔН = 0, ΔV = 0). Такие растворы, в которых отсутствует взаимодействие между частицами, называются идеальными.
|
|
|
· Однако, еще Менделеев фиксировал выделение тепла при растворении спирта в воде и изменении объема получившегося раствора, что является верным признаком химической реакции [37]. Собственно, именно из-за этого явления при разбавлении концентрированных кислот водой необходимо соблюдать осторожность. Из-за сильного теплового эффекта раствор даже может быть в процессе кипения выброшен из колбы, с печальными последствиями. Взаимодействие между растворителем и растворенным веществом называется сольватацией. Если растворителем выступает вода, то тогда процесс называется гидратацией. Сольватация является полноценной химической реакцией, так как в результате образуются новые химические связи и рвутся старые. Со всеми характерными признаками – с поглощением или выделением тепла, с изменением объема раствора, и в некоторых случаях, с изменением цвета. Поэтому химическая теория рассматривала процесс растворения как результат химической реакции, в результате которого образуется сложная смесь продуктов переменного состава. Продукт процесса гидратации – кристаллогидраты, являются комплексными соединениями и могут быть легко выделены из раствора.
Современная термодинамическая теория объединяет эти два подхода. В рамках современной теории движущей силой процесса растворения является и увеличение энтропии при образовании раствора, и сольватация. Что в очередной раз доказывает, что природе безразлично, в рамках какой науки производится изучении ее сложных процессов, они неразделимы. Поэтому, идеальный раствор – это очередная недостижимая абстракция, реальные растворы могут только приближаться к идеальным.
Примеры решения задач на расчет концентраций.
Задача 1. Рассчитать массовую долю (W), молярную долю (N), молярную концентрацию (C), молярную концентрацию эквивалента (Cэ), моляльность(Cm) серной кислоты в её водном растворе, содержащем 106,6 грамм растворенного вещества в 1 литре. Плотность раствора 1,066 г/мл.
Решение:
1) Для расчета массовой доли нужны масса вещества и масса раствора. Масса вещества есть 106,6 г. Массу раствора можно определить умножив плотность на объем: mр-ра=ρ×V=1,066 г/мл × 1000 мл = 1066 г.
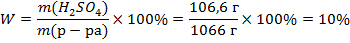
2) Для расчета молярной доли нужно знать количество вещества серной кислоты и количество вещества всех частиц в растворе, в нашем случае это сумма количеств вещества воды и серной кислоты. Для определения количества вещества серной кислоты нужно её массу поделить на молярную массу:
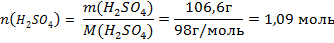
Молярная масса серной кислоты численно равна сумме относительных атомных масс атомов в молекуле. Они указаны в таблице Менделеева: Ar (H) =1, Ar(S)=32, Ar(O)=16.
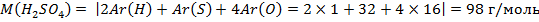
Аналогично высчитывается количество вещества воды. Масса воды, очевидно, равна разности между массой раствора и серной кислоты: 1066 г – 106,6г = 959,4 г. Молярная масса воды: 
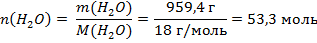
Молярная доля вещества равна отношению количества его частиц к количеству частиц в растворе:
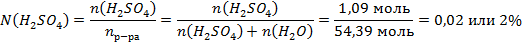
3) Молярная концентрация показывает, какое количество вещества содержится в 1 литре раствора.
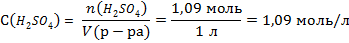
Иногда в условиях подобных задач отсутствует объем раствора, в таком случае можно взять любую величину, удобную для расчетов. Чаще всего это 1 литр.
4) Для расчета молярной концентрации эквивалента потребуется знать фактор эквивалентности. В случае с кислотами нужно написать уравнение её диссоциации:
H2SO4 D 2H++SO42-
При диссоциации 1 молекулы кислоты высвобождается 2 протона, значит, фактор эквивалентности равен f(H2SO4)=½. Для расчета молярной концентрации эквивалента (она – же «нормальность») нужно молярную концентрацию разделить на фактор эквивалентности:
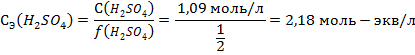
5) Моляльность – это количество вещества, которое содержится в одном килограмме растворителя:
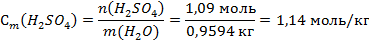
Ответ: W(H2SO4) = 10%, N(H2SO4)=2%, C(H2SO4)=1,09 моль/л, Сэ(H2SO4)=2,18 моль-экв/л, Сm(H2SO4)=1,14 моль/кг.
Задача 2. Даны два раствора некоторого вещества, с концентрацией 35% и 15% (масс.). Какие массы этих растворов нужно взять для приготовления 200 г 25% раствора?
Такая задача решается двумя способами.
Дата добавления: 2018-04-05; просмотров: 234; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
