III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность. 10 страница
P= νRT/V, V= νRT/P, T=PV/Rν
Следовательно, в данном случае, число степеней свободы равно 3.
Изменение состояния термодинамической системы, в результате которого меняется значение её функций состояния, называется термодинамическим процессом, либо термодинамическим переходом. Строго говоря, в термодинамике рассматриваются равновесные состояния, такие состояния, которые не меняются при постоянстве внешних условий. Таким образом, термодинамический переход осуществляется между двумя равновесными состояниями. Термодинамические процессы могут осуществляться обратимо и необратимо:
· Если термодинамическую систему и окружающую среду после проведения процесса можно вернуть в исходное состояние, то такой процесс называется обратимым.
· Если термодинамическую систему и окружающую среду после проведения процесса нельзя вернуть в исходное состояние, то такой процесс называется необратимым.
Необратимый процесс можно провести в обратном направлении, и термодинамическая система вернется в исходное состояние, но при этом сохранятся следы такого запуска в окружающей среде, то есть, окружающая среда в исходное состояние вернуться не сможет.
Помимо этого, термодинамические процессы делятся на самопроизвольные и несамопроизвольные:
· Самопроизвольные процессы (положительные, естественные) протекают самостоятельно без вмешательства со стороны окружающей среды.
|
|
|
· Несамопроизвольные процессы (отрицательные, неестественные) не могут протекать самостоятельно. Для их реализации необходимо вмешательство со стороны окружающей среды.
У функций состояния есть очень важная особенность, которая позволяет использовать их в практических расчетах для характеристики термодинамических процессов. Их величины зависят только от начального и конечного состояний системы, и не зависят от того, через какой процесс или серию процессов система пришла в конечное состояние. Математически это можно выразить следующим образом: Δf = fкон – fнач. Поэтому зачастую большим значением обладает не столько значение функции состояния, сколько её изменение в результате термодинамического процесса. В химии используются следующие функции состояния:
· внутренняя энергия, U;
· энтальпия, Н;
· энтропия, S;
· свободная энергия Гиббса (изобарно-изотермический потенциал), G;
· свободная энергия Гельмгольца (изохорно-изотермический потенциал), F.
Внутренняя энергия (U) – это сумма всех видов энергий в системе. В эту величину включаются дефект масс, энергия колебания и вращения химических связей, энергия теплового движения частиц, энергия межмолекулярных взаимодействий и т.д. Измеряется U в Дж, Дж/моль. Из определения, очевидно, что абсолютное значение U системы измерить невозможно. Но можно измерить изменение (ΔU) в результате т/д процесса. ΔU считается положительной (ΔU > 0), если при протекании какого-либо процесса внутренняя энергия возрастает, и отрицательной (ΔU < 0), если при протекании какого-либо процесса она уменьшается. Все способы изменения внутренней энергии делятся на две больших категории – совершение работу и передача теплоты:
|
|
|
• Теплота (Q) – это форма передачи энергии, которая осуществляется за счет хаотического столкновения частиц двух соприкасающихся тел.
• Работа (A или W) – это форма передачи энергии, которая осуществляется при перемещении масс, состоящих из большого количества частиц, под действием каких-либо сил.
Работа, совершаемая над системой и подводимая теплота считаются положительными величинами, а работа совершаемая системой и отдаваемая ей теплота – отрицательными. В отличие от внутренней энергии Q и А не являются функциями состояния. Их значение зависит от пути процесса.
Первый закон термодинамики устанавливает связь между теплотой(Q) изменением внутренней энергии (DU) и работой:
|
|
|
Q = DU + A
Первый закон термодинамики: подводимая к системе теплота тратится на увеличение внутренней энергии системы и на совершение этой системой работы над внешней средой. Эта формулировка первого закона термодинамики (иногда его называют первым началом термодинамики) не является единственной:
· Энергия не может быть создана или уничтожена, она лишь переходит из одного вида в другой в различных физических процессах. Отсюда следует, что внутренняя энергия изолированной системы остается неизменной.
· Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы против внешних сил.
· Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе и не зависит от способа, которым осуществляется этот переход.
· Вечный двигатель первого рода невозможен. Под вечным двигателем понимается устройство, которое могло – бы получать энергию из «ниоткуда», создавать её для своей работы.
Однако, очевидно, что все эти формулировки сводятся к приведенному выше математическому выражению для внутренней энергии.
|
|
|
Как уже упоминалось выше, химическое вещество является частным случаем термодинамической системы, а, следовательно, процесс превращения одного вещества в другое является частным случаем термодинамического процесса. Работу можно представить как сумму полезной работы и работы сил расширения:
A = Aп + Aр
Полезная работа для химических процессов (Aп) зачастую равна 0. Работа сил расширения определяется по формуле Aр = PDV. Чаще всего химические процессы протекают при изобарных и изохорных условиях. В изобарных условиях давление постоянно P=const, в записи уравнений у переменных появляется нижний индекс p (например, теплота изобарного процесса – QP). В изохорных условиях постоянен объем, V=const, в записи уравнений у переменных появляется нижний индекс V (например, теплота изобарного процесса – QV).
В изобарных условиях P=const, тогда Aр = PDV можно представить как Aр = PVкон - PVнач, изменение внутренней энергии можно представить как ΔU = Uкон - Uнач. Тогда первый закон термодинамики для изобарных условий можно переписать:
Qр = DU + PDV
Qр = Uкон – Uнач + PVкон- PVнач
Несложно видеть, что функции состояния можно попарно объединить:
Qр = (Uкон+PVкон) – (Uнач+PVнач)
Выражение U+pV соответствует функции состояния энтальпии (H), таким образом ΔQр=ΔH. Следовательно, во-первых, теплота при изобарном процессе приобретает свойства функции состояния, она не зависит от пути процесса, а во-вторых, при изобарном процессе подводимая к системе теплота расходуется на увеличение энтальпии (теплосодержания системы). Определение энтальпии дается именно через эти два выражения(H=U+pV и ΔQр=ΔH). Энтальпия, это энергия системы, которая доступна для преобразования в теплоту при определённом постоянном давлении. Здесь следует обратить внимание на величины, через которые высчитывается энтальпия. В неё входит внутренняя энергия, а её абсолютное значение установить невозможно. Значит, и для энтальпии невозможно определить абсолютное значение. Остается только измерять её изменение в результате проведения химической реакции. Поскольку энтальпия является энергетической характеристикой, то измеряется она в Дж и Дж/моль.
В изохорных условиях постоянен объем. В этом случае совершение работы расширения системой по определению невозможно, DV=0, значит и AV = PDV = 0. Тогда первый закон термодинамики принимает вид:
QV = DU + PDV
QV = DU
Аналогично, для изохорного процесса теплота приобретает свойства функции состояния. Таким образом, из первого закона термодинамики вытекают два важных следствия, но которых базируются расчеты теплового эффекта химической реакции:
1) Первое математическое следствие из первого закона термодинамики: при изобарных и изохорных процессах теплота становится функцией состояния.
2) Поскольку большинство реакций протекают при изобарных условиях, то энергетический эффект реакции оценивается изменением энтальпии ΔH.
Расчеты теплового эффекта реакции проводятся на основе закона Гесса, который является основой термохимии – раздела химической термодинамики, в котором вычисляются тепловые эффекты различных физико-химических процессов. Под физико-химическими процессами понимаются не только химические реакции, но и фазовые переходы (плавление, кристаллизация, испарение, конденсация), процессы растворения и т. д. Итак, под тепловым эффектом химической реакции(Q) понимается теплота, выделяемая или поглощаемая в результате превращения исходных веществ в количествах, соответствующих уравнению химической реакции. Соответственно, энтальпия реакции (ΔH) – это количество энергии, которое система потеряла(если энергия выделяется) или приобрела (если энергия поглощается) в результате проведения химической реакции в виде тепла. Энтальпия реакции равна тепловому эффекту и обратна ему по знаку. А закон Гесса уточняет, что тепловой эффект химической реакции не зависит от пути ее протекания, а зависит лишь от природы и физического состояния исходных веществ и продуктов реакции. То есть, тепловой эффект химической реакции является функцией состояния – первое следствие из первого закона термодинамики.
Определение теплового эффекта реакции указывает на то, что продукты реакции и исходные вещества должны иметь одинаковую температуру. Дело в том, что тепловой эффект зависит от условий проведения реакции. Поэтому измерение теплового эффекта реакций проводится при стандартных условиях: температура 250С и давление 1 атм. Величины, определенные при стандартных условиях, называются стандартными. Стандартные величины обозначаются верхним индексом «0» и нижним температурным индексом, который выражается в шкале Кельвина. Например, стандартная энтальпия реакции обозначается как DН0298.
В законе Гесса указывается на важность обозначения физического состояния вещества, поэтому в термохимических уравнениях оно указывается нижним индексом в скобках, после формулы вещества:
Н2(г) + Cl2(г) = 2HCl(г) DН0298 = - 184,6 кДж.
Кроме того, в термохимическом уравнении указывается тепловой эффект реакции. Термохимические уравнения – единственные химические уравнения, в которых допустимо использовать знак «=» вместо стрелок.
В зависимости от того, поглощается энергия в результате химической реакции (и термодинамического процесса в общем случае) их делят на экзотермические и эндотермические:
· В экзотермических («экзо» - вне, снаружи) реакциях происходит выделение тепла. Тепловой эффект такой реакции считается положительным, а энтальпия отрицательной.
· В эндотермических («эндо» - внутри) реакциях происходит поглощение тепла. Тепловой эффект такой реакции считается отрицательным, а энтальпия положительной.
Из закона Гесса существуют три следствия, которые широко используются в термохимии:
1) Первое следствие: тепловой эффект прямой реакции равен тепловому эффекту обратной реакции с противоположным знаком:
DНпр.= - DНобр.
2) Второе следствие: тепловой эффект реакции равен разности между суммой теплот (энтальпий) сгорания исходных веществ и суммой теплот (энтальпий) сгорания продуктов реакции с учетом стехиометрических коэффициентов веществ, участвующих в процессе:
DН = S(ni DcНi)исх. - S(ni DcНi )прод.,
где ni – стехиометрический коэффициент для i-го вещества в уравнении реакции, ∆cНi – энтальпия сгорания i-го вещества (с – сокращение от англ. «combustion»).
Теплота (энтальпия) сгорания – количество теплоты, которое выделяется при полном сгорании одного моля вещества до высших оксидов при стандартных условиях. Обычно теплоты сгорания используются для термохимических расчетов в реакциях органической химии. Теплоты сгорания измеряются в Дж/моль.
3) Третье следствие: тепловой эффект реакции равен разности между суммой теплот (энтальпий) образования продуктов реакции и суммой теплот (энтальпий) образования исходных веществ с учетом стехиометрических коэффициентов веществ, участвующих в процессе:
DН= S(ni DfНi)прод. - S(ni DfНi)исх,
где ni – стехиометрический коэффициент для i-того вещества в уравнении реакции, ∆fН i – энтальпия образования i-того вещества (f – сокращение от англ. «formation»).
Теплота (энтальпия) образования – тепловой эффект реакции образования 1 моль вещества из простых веществ. Теплоты образования измеряются в кДж/моль. Стандартные теплоты образования сложных веществ приведены в соответствующих справочниках, а стандартные теплоты образования простых веществ принимаются равными 0.
Иногда, если необходимо указать энтальпию образования или сгорания 1 моль вещества в соответствующем химическом уравнении могут появится дробные стехиометрические коэффициента. Так, например, энтальпия сгорания 1 моль жидкого бензола равна -3358 кДж:
C6H6(ж)+7,5O2(г) = 6CO(г) +3H2O(ж) DcН0298 = -3358 кДж
А теплота образования 1 моль хлорида натрия равна 411 кДж:
Na(т)+0,5Cl2(г)= NaCl(т) fQ0298 = 411 кДж
Обе реакции являются экзотермическими.
Так как теплоты образования и сгорания веществ являются их индивидуальными характеристиками, то с их помощью можно теоретически вычислить тепловой эффект неисследованных реакций. Кроме того, раз химическое уравнение является именно уравнением в математическом смысле, то с ними можно производить аналогичные операции – складывать, вычитать, умножать на число и так далее. Если такая операция проводится с уравнением, то аналогичные действия совершаются и с указанной энтальпией (тепловым эффектом) реакции. Это позволяется рассчитывать энтальпию (тепловой эффект) неисследованных реакций, пользуясь энтальпией известных.
Итак, пользуясь первым законом термодинамики можно вычислить тепловой эффект реакции. Но эти сведения не помогут ответить на вопрос о самопроизвольности таких процессов. Казалось – бы, согласно принципу наименьшей энергии самопроизвольно должны идти процессы, в которых выделяется энергия, то есть экзотермические. Однако, это не так. Например, при растворении солей аммония наблюдается поглощение тепла. Это эндотермический процесс, но он произвольный. Поэтому, одной энтальпии недостаточно для описания термодинамической системы. Собственно, формулировки второго закона термодинамики, постулирует существование еще одной функции состояния – энтропии:
Формулировка Клаузиуса: Никакая совокупность процессов не может сводиться к передаче теплоты от холодного тела к горячему, тогда как передача теплоты от горячего тела к холодному может быть единственным результатом процесса. Более известна её упрощённая форма: тепло не может самопроизвольно передаваться от менее нагретого тела к более нагретому.
Формулировка Кельвина: Никакая совокупность процессов не может сводиться только к превращению теплоты в работу, тогда как превращение работы в теплоту может быть единственным результатом процесса.
Формулировка Оствальда: Вечный двигатель второго рода невозможен.
При передаче теплоты какому – либо телу изменяется еще одна его функция состояния – энтропия(S). Поэтому 100% полученной теплоты невозможно превратить в работу, часть обязательно будет потрачена на изменение внутренней энергии системы. Следовательно, двигатель, который превращает 100% подводимой теплоты в работу сконструировать невозможно – это и есть вечный двигатель второго рода. Так что – же такое энтропия? Это количественная мера беспорядка (хаоса) в системе. Чем выше значение энтропии, тем более беспорядочной является система. Математически энтропия определяется как функция от числа микросостояинй, при котором возможно существование данного макросостояния (W):
S=RTlnW
Для примера рассмотрим систему из керамической чашки и комнаты. В первом состоянии чашка целая. Для целой чашки в комнате существует W1 микросостояний – чашка может быть перевернута вверх дном или вниз дном, её ручка может быть обращена на север, юг, запад или восток, чашка может находиться на столе, тумбе, полу и так далее. Для разбитой чашки, состояний W2 намного больше – каждый фрагмент может находиться где угодно, и как угодно повернут. Поэтому энтропия второго состояния намного больше.
Еще одна формулировка второго начала термодинамики заключается в том, что самопроизвольно в изолированных системах протекают процессы, в результате которых увеличивается энтропия. То есть DS=Sкон–Sнач>0. Переход из менее упорядоченного состояния в более упорядоченное без воздействия извне невозможен. В таком случае DS<0. Вернемся к примеру с чашкой. Переход от целой чашки к её фрагментам является самопроизвольным, так как набор фрагментов обладает большей энтропией. Обратный процесс – собирание чашки из её осколков несамопроизволен, так как будет протекать с уменьшением энтропии. Было – бы, конечно, замечательно, если упавшая на пол и разбившаяся чашка могла – бы самостоятельно собраться из осколков, но это запрещено вторым законом термодинамики.
Так как энтропия является функцией состояния, то для химической реакции её можно вычислить как разность сумм энтропий конечного (сумма энтропий продуктов реакции) и начального состояния (сумма энтропий исходных веществ):
DSр.= S(ni S i)прод. - S(ni S i)исх.
Энтропия измеряется в 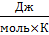 . Её стандартные значения для участвующих в реакции веществ можно найти в соответствующих справочниках.
. Её стандартные значения для участвующих в реакции веществ можно найти в соответствующих справочниках.
Хорошо, самопроизвольными являются процессы, которые идут с увеличением степени хаоса в системе, с увеличением энтропии. Значит, можно использовать значение энтропии процесса как критерий его направления? Нет. Ещё раз внимательно посмотрим на второй закон термодинамики: самопроизвольно в изолированных системах протекают процессы, в результате которых увеличивается энтропия. Это правило работает для изолированных систем. А системы, в которых протекают химические процессы, являются закрытыми или открытыми. Поэтому придется ввести две функции состояния – энергию Гиббса и энергию Гельмгольца.
Энергия Гиббса (G) используется для определения направления химической реакции в изобарно-изотермических условиях. Энергия Гиббса – это часть энергии системы, которая может быть превращена в работу. Она связана с энтальпией и энтропией следующим образом:
Дата добавления: 2018-04-05; просмотров: 274; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
