III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность. 7 страница
Первый тип химической связи, σ-связь возникает когда перекрывание двух облаков происходит вдоль прямой, соединяющей центры двух атомов. Для такого перекрывания подойдут электронные облака любой формы (рисунок 3.5):
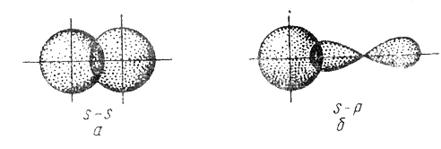

Рисунок 3.5. Образование σ-связей.
На этом рисунке видно, что такое перекрывание может быть сформировано двумя s-облаками (а), s- и p-о облаками (б), двумя p- облаками (в) и двумя d- облаками (г). При таком расположении электронных облаков достигается максимально возможная степень их перекрывания. Поэтому из всех видов химических связей σ-связь является самой прочной, у неё наибольшая энергия связи, а, значит, такая ковалентная связь образуется первой. Под одинарным валентным штрихом в химических формулах скрывается именно она: H-H (рисунок 3.5, а), H-Cl (рисунок 3.5, б), Cl-Cl (рисунок 3.5, в).
Второй тип химической связи, π-связь возникает когда перекрывание электронных облаков происходит по обе стороны прямой, соединяющей центры двух атомов. Для такого перекрывания s-облако уже не подходит, степень перекрывания получится слишком маленькой. Такая связь может образоваться в результате перекрывания d- и f-облаков (рисунок 3.6):
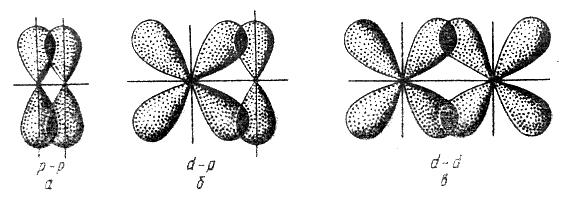
Рисунок 3.6. Образование π-связей.
Этот тип связи обладает меньшей степенью перекрывания электронных облаков, чем σ-связь, а, следовательно, меньшей энергией связи. Поэтому π-связь формирует только после того, как будут исчерпаны возможности по формированию σ-связи. То есть, π-связи встречаются только в кратных химических связях, двойных и тройных. Например, молекуле C=O имеется двойная связь. Одна из них σ-связь, другая π-связь. В молекуле азота с тройной связью N≡N одна σ-связь и две π-связи.
|
|
|
Энергия π-связи меньше, чем энергия σ-связи, но так как энергия двойной связи складывается из энергии σ-связи и π-связи, то суммарная энергия двойной связи больше чем энергия одинарной. Аналогично, раз тройная связь формируется одной σ-связью и двумя π-связи, то её энергия связи складывается уже из трёх составляющих: энергии σ-связьи и двух энергий π-связей. Поэтому энергия тройной связи больше, чем энергия двойной связи: E-<E=<E≡.
Связи типа δ образуются при боковом перекрывании всех четырех «лепестков» d-облаков (рисунок 3.7):

Рисунок 3.7. Боковое перекрывание d-облаков.
Очевидно, облака s и p не могут участвовать в формировании δ-связей.
Общая пара электронов, за счет которой формируется химическая связь, не обязательно находится посередине между двумя атомами. Ядра атомов, будучи положительно заряженными, тянут общую электронную пару к себе. Получается своеобразное соревнование по перетягиванию каната, где в роли спортсменов выступают атомные ядра, а в роли каната – общая электронная пара. Мерой силы атомов в этом соревновании является их электроотрицательность:
|
|
|
Если силы спортсменов одинаковы (одинаковая электроотрицательность у атомов), то и канат не перемещается – атомы тянут электронную пару к себе с одинаковой силой, и она остается ровно посередине между ними. В результате электрический заряд такой химической связи не меняется. Такая связь называется ковалентной неполярной. Ковалентная неполярная связь образуется, если атомы принадлежат к одному элементу а, значит, у них одинаковая электроотрицательность.
Если силы спортсменов неравны (различная электроотрицательность у атомов), то канат перетягивается в сторону сильного спортсмена – электронная пара смещается в сторону более электроотрицтального атома. В результате у химической связи появляются два полюса: положительный (менее электроотрицательный атом, потерявший отрицательную электронную пару) и отрицательный (более электроотрицательный атом, стянувший к себе отрицательную электронную пару). Ковалентная связь называется полярной, если общая электронная пара смещена в сторону более электроотрицательного атома. Разумеется, чем больше разница в электроотрицателностях атомов (силах спортсменов), тем сильнее от центра будет смещена электронная пара (канат). Заряды, которые приобретают атомы при полярной ковалентной связи, называются эффективными и обозначаются буквой δ. Они обозначаются верхним правым индексом. Например, молекула HCl образована двумя атомами, с относительными электроотрицательностями 2,1 (H) и 3,0 (Cl). Хлор, стягивая на себя общую электронную пару, приобретает отрицательный заряд, а водород, потерявший общую электронную пару, приобретает положительный заряд:
|
|
|
H·+·Cl®H+δ –Cl-δ
И чем больше разница в электроотрицательностях атома, тем больше по величине эти заряды. Однако, молекула по-прежнему является электронейтральной – сумма всех эффективных зарядов равна 0. Количественной мерой полярности связи служит электрический момент диполя (μ), равный произведению эффективного заряда δ на длину диполя l:
μ= δ × l.
Полярность связи не следует путать с поляризуемостью. Поляризуемость – это способность становиться полярной (или более полярной) в результате действия на молекулу внешнего электрического поля. От поляризуемости связи зависит то, как химическая связь распадается в процессе химических реакций.
|
|
|
Если связь в данных условиях поляризуется, то происходит гетеролитический разрыв химической связи – в результате такого разрыва общая электронная полностью смещается к электроотрицательному атому, и он становится отрицательно заряженным ионом - анионом:
H:Cl®H++:Cl-
Атом, лишившийся общей пары, становится положительно заряженным ионом – катионом. В результате этой реакции образовался катион водорода (H+) и анион хлора (Cl-). Так происходит разрыв связи в процессе электролитической диссоциации в воде.
Если связь данных условиях не поляризуется, то происходит гомолитический разрыв связи – общая электронная пара распадается, оставляя каждому атому по электрону. В результате образуются частицы с неспаренными электронами – радикалы:
H:Cl®H·+·Cl
Таким образом молекула HCl распадется при нагревании.
Подытожим. Химическая связь является результатом сложных электронно-протонных взаимодействий. Количественно химическую связь можно охарактеризовать с помощью её длины, энергии и валентного угла. В рамках МВС образование ковалентной связи происходит в результате перекрывания электронных облаков и формированием общей электронной пары. Образование ковалентной связи возможно по двум механизмам: обменному и дононо-акцепторному. Ковалентная связь обладает рядом характерных свойств: насыщаемостью, направленностью полярностью и поляризуемостью.
Вопросы для самоконтроля
1) Что такое химическая связь?
2) С помощью каких методов можно описать химическую связь, и в чем их различие?
3) Как описывается образование ковалентной связи в рамках МВС?
4) Каким образом может происходить перекрывание электронных облаков?
5) Какими свойствами обладает ковалентная связь? Есть – ли разница между связями, образованными по донорно-акцепторному механизму и обменному?
6) Почему молекула воды не может иметь химический состав HO?
7) Из связей какого типа состоит химическая связь, обозначаемая тройным валентным штрихом?
8) Пользуясь таблицей относительных электроотрицательностей определите тип ковалентной связи в молекуле фосфина (PH3).
3.2 Гибридизация электронных облаков. Форма молекул.
Вернемся к примеру образования катиона аммония (NH4+). Выше был описан тот факт, что в катионе аммония все связи являются одинаковыми. Положительный заряд равномерно распределен между ними. В данном случае, между связями, образованными по обменному механизму, и связью, образованной по донорно-акцепторному, нет разницы. Но ведь одна из них образована за счет s-облака, а остальные три за счет p-облаков. Возможно, все дело в донорно-акцепторном механизме, который изменяет полученные химические связи?
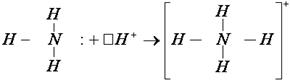
Возьмем похожую молекулу, связи в которой так – же образованы центральным атомом с атомами водорода за счет одного s и трёх p-облаков, но исключительно по обменному механизму – молекулу метана (CH4):
6C* 1s2  2s1
2s1  2p3
2p3 


1H 1s1 
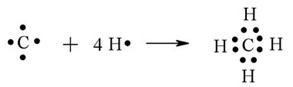
Если измерить длину связей и их энергию, то окажется, что в молекуле метана они тоже равноценны. Казалось – бы, связи образованы за счет разных электронных облаков 2s и трёх 2p, с разной энергией и формой, значит, и связи должны отличаться друг от друга. Но нет. Для объяснения этого явления была создана модель гибридизации электронных облаков. Идея этой модели заключается в понятии гибридизации – выравнивании по форме и энергии электронных облаков с образованием новых, одинаковых по форме и энергии. Новые облака называются гибридными, их число равно сумме электронных облаков, участвующих в гибридизации. Основные положения этой модели таковы:
Если у атома, вступающего в химическую связь, имеются электронные облака различной формы, то в процессе образования химической связи происходит гибридизация этих облаков. Новые облака называются гибридными, их число равно сумме исходных облаков, участвующих в гибридизации.
Здесь необходимо отметить, что модель гибридизации, основанная на модели электронного облака, является лишь нашим представлением о неизвестных реальных процессах. Эта модель является удобным инструментом, с помощью которого можно объяснить некоторые особенности образования химической связи. Если будет создан другой, более совершенный инструмент, то от модели гибридизации откажутся.
2. Форма гибридного облака отличается от формы исходного. В гибридном облаке электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с электронным облаком другого атома происходит максимальное перекрывание, которое приводит к повышению энергии связи.
Ниже на рисунке 3.8 представлены два примера формы гибридных облаков:

Рисунок 3.8. Формы гибридных облаков.
Слева на этом рисунке представлена форма гибридного облака, которое получилось в результате гибридизации s и p облаков, справа форма гибридного облака, образованного из p и d облаков. Как видно из этих рисунков, при образовании σ-связей гибридные облака, из-за асимметричного строения, смогут образовать более полное перекрывание, чем в случае перекрывания двух негибридных облаков.
Тип гибридизации определяется тем, какие исходные облака в неё вступают:
1) sp-гибридизация. В данном случае в гибридизацию вступают одно s и одно p облако. В результате получается два гибридных, которые равноценны друг – другу. Это значит, что в пространстве имеются две зоны с электронами, которые отталкиваются друг от друга. Впрочем, в случае из двух точек все просто, как бы их не расположить – все равно получится линия, валентный угол будет равен 1800 (рисунок 3.9):

Рисунок 3.9. sp-гибридизация.
2) sp2- гибридизация. В данном случае в гибридизацию вступают одно s и два p-облака. В результате получается три гибридных. Так как они равноценны друг другу, то формируют правильный треугольник, с валентным углом 1200 (рисунок 3.10):
 |
Рисунок 3.10. sp2- гибридизация.
3) sp3- гибридизация. В данном случае в гибридизацию вступают одно s и три p-облака. В результате получается четыре гибридных, которые одинаково взаимодействуют друг с другом. Поэтому они образуют… нет, не квадрат. Речь идет не о плоскости, а о пространстве, поэтому они образуют правильный тетраэдр с валентным углом 109028’(рисунок 3.11):
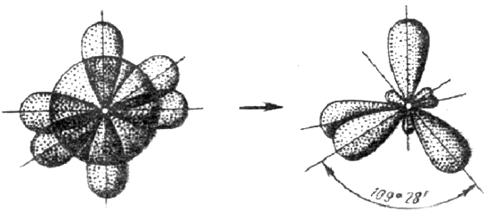
Рисунок 3.11. sp3- гибридизация.
Это основные типы гибридизации, но помимо s и p облаков возможно вступление d и f-облаков в гибридизацию.
4) sp3d- гибридизация. Вступает в гибридизацию пять облаков: одно s, три p и еще одно d. Пять точек в пространстве располагаются в виде т.н. тригональной бипирамиды (рисунок 3.12).
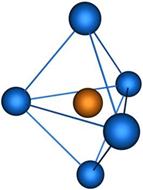

Рисунок 3.12. Размещение атомов в случае sp3d (слева) и sp3d2-гибридизации (справа).
5) sp3d2- гибридизация. Вступает в гибридизацию шесть облаков: одно s, три p и еще два d. Шесть точек в пространстве располагаются в виде тетрагональной бипирамиды (октаэдра) (рисунок 3.12).
Как видно из рисунков 3.9-3.12 форма молекулы определяется типом гибридизации центрального атома. В качестве примера определим форму молекулы метана (CH4). Атом углерода в молекуле метана находится в возбужденном состоянии, у него на 2s и 2p подуровнях находится четыре неспареных электрона:
6C* 1s2  2s1
2s1  2p3
2p3 


Эти облака вступают в гибридизацию. Одно s-облако и три p-облака, очевидно, гибридизуются по типу sp3. Все атомы, которые образуют связь с гибридными облаками углерода одинаковы, это атома водорода:
1H 1s1 
Поэтому молекула будет симметричной. Тип гибридизации центрального атома определяет форму молекулы. Четыре гибридных облака – четыре вершины для фигуры в пространстве – тетраэдрическая молекула (рисунок 3.13):

Рисунок 3.13. Электронные облака молекулы метана.
Валентный угол совпадает с углом правильного тетраэдра - 109028’.
Но помимо тех облаков, которые непосредственно вступают в процесс формирования химической связи, на форму молекулы оказывают влияние и те облака валентного уровня, на которых остались электронные пары. Вернемся к молекуле аммиака (NH3). У центрального атома азота помимо трёх неспареных электронов на 2p-подуровне имеется еще и электронная пара на подуровне 2s:
7N 1s2  2s2
2s2  2p3
2p3 


И облако с этой парой электронов тоже вступает в процесс гибридизации. Поэтому, в молекуле аммиака тип гибридизации центрального атома аналогичен типу гибридизации атома углерода из предыдущего примера. Три p-облака, содержащие неспаренные электроны, и s-облако с парой электронов гибридизуются по типу sp3. Однако, в этот раз молекула не будет симметричной. Ведь пара электронов азота не тратится на образование химической связи с атомами водорода. Поэтому, интенсивность взаимодействия этой пары со своими соседями – химическими связями будет отличаться от взаимодействия между этими связями. То есть, одна из вершин в тетраэдре становится неравноценной остальным, поэтому форма тетраэдра будет искажаться. Валентный угол в молекуле аммиака близок к углу правильного тетраэдра, но не равен ему. Он составляет примерно 1070[28]. Электронные облака в молекуле аммиака располагаются следующим образом (рисунок 3.14):
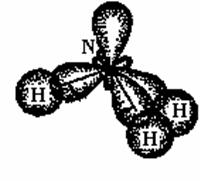
Рисунок 3.14. Электронные облака молекулы аммиака.
Итак, форма молекулы определяется типом гибридизации. Гибридизация – это выравнивание электронных облаков по форме и энергии. Процесс гибридизации выгоден атому, так как новая форма гибридного облака позволяет образовывать более полное перекрывание, и следовательно, энергия образованной такими облаками химической связи будет больше. В гибридизацию вступают облака валентных уровней, которые содержат неспаренные электроны, непосредственно участвующие в химической реакции, а так – же облака с парами электронов.
Пример решения задачи на определение формы молекулы.
Задание: определить форму молекулы воды (H2O).
Решение:
Электронная конфигурация центрального атома - кислорода 1s2 2s2 2p4
8O 1s2  2s2
2s2  2p4
2p4 


Электронная конфигурация атома водорода 1s1
1H 1s1 
У центрального атома имеется 2 пары электронов на 2s и 2p орбиталях и два валентных электрона на двух 2p орбиталях. Отсюда, тип гибридизации атома кислорода sp3. У атома водорода имеется всего лишь одно электронное облако, тут нечему вступать в гибридизацию. Значит, исходной фигурой для поиска формы молекулы является тетраэдр, и валентный угол должен быть близок к тетраэдрическому. Так как две орбитали заняты парами электронов, то молекула воды имеет угловое строение:
Дата добавления: 2018-04-05; просмотров: 465; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
