III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность. 11 страница
G=H-TS
Так как абсолютное значение энтальпии установить невозможно, то и значение энергии Гиббса тоже остается неизвестным. Направление реакции
Определяется изменением энергии Гиббса (DG):
DG=DH-TDS
· если в химическом процессе происходит снижение свободной энергии Гиббса, т.е. DG < 0, процесс может протекать самопроизвольно, или говорят: процесс термодинамически возможен;
· если продукты реакции имеют больший термодинамический потенциал, чем исходные вещества, т.е. DG > 0, процесс протекать самопроизвольно не может, или говорят: процесс термодинамически невозможен;
· если DG = 0, то реакция может протекать как в прямом, так и в обратном направлении, т.е. реакция обратима.
То есть, самопроизвольные процессы в закрытых и открытых системах в изобарно-изотермических условиях идут с уменьшением энергии Гиббса. Поскольку энергия Гиббса это тоже функция состояния, то она может быть рассчитана как разность между конечным и исходным состоянием системы. Обычно для таких расчетов используются стандартные справочные величины:
DG0298 = S(ni.DGi0298)пр. - S(ni.D Gi0298)исх.
Аналогично энергии Гиббса при изохорно-изотермических условиях используется энергия Гельмгольца:
DF = DU – TDS
Критерии направления процесса те – же самые: самопроизвольные процессы в закрытых и открытых системах в изохорно-изотермических условиях идут с уменьшением энергии Гельмгольца.
Решение задач на тему «термодинамика»
|
|
|
Пример 1. Вычислить тепловой эффект реакции, определить, является – ли реакция экзотермической или эндотермической. Рассчитать энергию Гиббса и определить возможность протекания реакции при температурах 1000 и 3000 К, используя следующие справочные данные:
Cr2O3(т) +3С(т)→ 2Сr(т) +3СO(г)
| Cr2O3(т | С(т) | Сr(т) | СO(г) | |
| ΔfН0298, кДж/моль | — 1141 | 0 | 0 | — 110,6 |
| S0298, Дж/(моль×К) | 81,2 | 5,7 | 23,6 | 197,7 |
Решение:
Для вычисления изменения энергии Гиббса(DG) через энтальпию (DH) и энтропию (DS) используется следующая формула: DG=DH-TDS
.
1) Так как энтальпия является функцией состояния, то её изменение в процессе реакции можно рассчитать через разность энтальпий продуктов реакции и исходных веществ:
Н0= S(ni fН0i)прод. - S(ni DfН0i)исх,
DH0=3×ΔfН0(СO(г)) + 2×ΔfН0(Сr(т)) – 3×ΔfН0(С(т)) – ΔfН0(Cr2O3(т))
Множители перед энтальпиями являются стехиометрическими коэффициентами реакции. Раз в реакции образуется 3 моль оксида углерода (II) и 2 моль хрома, а исходных веществ 3 моль углерода и 1 моль оксида хрома (III), то на эти – же числа нужно умножить справочные величины:
DH0=3моль×(—110,6кДж/моль) + 2моль×0кДж/моль – 3моль×0кДж/моль – 1моль×(— 1141кДж/моль) = 809,2 кДж
Так как энтальпия системы имеет положительное значение, это значит, что система увеличивает свой запас энергии, поглощая тепло из окружающей среды. Эта реакция эндотермическая (протекает с поглощением тепла), а её тепловой эффект равен энтальпии реакции и обратен ему по знаку:
|
|
|
Q= –DH0= –809,2 кДж.
2) Энтропия тоже является функцией состояния, поэтому вычисляется аналогично:
DS0= S(ni S0i)прод. - S(ni S0i)исх.
DS0=3×S0(СO(г)) + 2×S0(Сr(т)) – 3×S0(С(т)) – S0(Cr2O3(т))
DS0=3моль×197,7 Дж/(моль×К) + 2 моль×23,6Дж/(моль×К) – 3моль×5,7Дж/(моль×К) – 1моль×81,2Дж/(моль×К) = 542 Дж/К
3) Энтропия высчитана в кДж, а энтальпия в Дж, эти величины нужно привести в соответствие. Если в условиях задачи указана размерность, в которой надо привести ответ, то нужно переводить энтальпию и энтропию в эту размерность, но в нашем примере таких указаний нет. Поэтому, мы можем перевести либо энтальпию в джоули, либо энтропию в килоджоули, принципиальной разницы в данном случае нет: DH0 = 809200 Дж. Теперь рассчитаем энергию Гиббса для двух температур:
Для 1000 К: DG=DH-TDS= 809200Дж-(1000К×542Дж/К) = 267200 Дж, или 267,2 кДж
Для 3000 К: DG=DH-TDS= 809200Дж-(3000К*542Дж/К) = -816800 Дж, или -816,8 кДж
Так как при 1000 К изменение энергии Гиббса положительно, то химическая реакция является несамопроизвольной, её протекание в данных условиях невозможно. А вот при 3000 К изменение энергии Гиббса отрицательно, и реакция будет самопроизвольной, её протекание при такой температуре возможно.
|
|
|
Ответ: Реакция является эндотермической, Q=-809,2кДж, при температуре 1000 К DG = 267,2кДж и реакция невозможна, при температуре 3000 К DG = (-816,8 кДж) и реакция возможна.
Пример 2. Вычислить тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
1. FeO(т) + CO(г) = Fe(т) + CO2(г) ΔH1=-18,2кДж
2. CO(г) + ½O2(г) = CO2(г) ΔH2=-283кДж
3. H2(г) +½O2(г) = H2O(г) ΔH3=-241,83кДж
Решение:
Реакция восстановления оксида железа (II) водородом:
FeO(т) + H2(г) → Fe(т) + H2O(г)
Пока нам неизвестен тепловой эффект этой реакции мы не имеем права поставить в ней знак «=». Знак равенства ставится только в том случае, если в правой и левой части химического уравнения уравнен не только материальный баланс (количество атомов), но и энергетический (то есть указан либо тепловой эффект реакции, либо её энтальпия).
|
|
|
Химические уравнения - это настоящее математическое уравнение, в котором левая часть равна правой. Поэтому, с химическими уравнениями можно производить такие - же операции, как и с другими математическими выражениями. Их можно умножать или делить, складывать, вычитать, или переносить переменные из одной части уравнения в другую с противоположным знаком. Если мы, например, сложим два термохимических уравнения, то сложатся и их энтальпии (или тепловые эффекты). Поэтому решение задачи заключается в комбинировании исходных трёх уравнений для получения искомого, а затем проделать эти – же операции с их тепловыми эффектами. Смотрим на искомое уравнение. В его левой части есть оксид железа FeO(т) и водород H2(г). Эти вещества есть уравнениях №1 и №3. Сложим их, левую часть с левой частью и правую часть с правой частью:
FeO(т) + CO(г) = Fe(т) + CO2(г) ΔH1=-18,2кДж
+
H2(г) +½O2(г) = H2O(г) ΔH3=-241,83кДж
FeO(т) + CO(г) + H2(г) +½O2(г) = Fe(т) + CO2(г) + H2O(г) ΔH=-260,03кДж
Теперь мы видим, что в полученном уравнении в левой части есть «лишние» вещества - оксид углерода (II) и кислород, а в правой - лишний оксид углерода (IV). Но, все эти вещества имеются в левой и правой части уравнения №2. Поэтому, если из полученного уравнения мы вычтем второе, то, как раз получится искомое:
FeO(т) + CO(г) + H2(г) +½O2(г) = Fe(т) + CO2(г) + H2O(г) ΔH=-260,03кДж
-
CO(г) + ½O2(г) = CO2(г) ΔH2=-283кДж
FeO(т) + H2(г) → Fe(т) + H2O(г) ΔH= - 22,97 кДж
Тепловой эффект реакции обратен по знаку энтальпии Q = - ΔН = - 22,97 кДж Ответ: - 22,97 кДж.
Вопросы для самоконтроля
1) Что такое термодинамика? В чем особенность этого раздела науки?
2) Что такое уравнение состояния? Каковы свойства функций состояния?
3) Какие функции состояния используются для решения химических задач?
4) В чем заключается смысл первого закона термодинамики? Какие существуют способы изменения внутренней энергии?
5) Каковы основы термохимии? Какими способами и при каких условиях можно рассчитать тепловой эффект реакции?
6) В чем заключается смысл второго закона термодинамики?
7) Почему требуется введение энергии Гиббса и энергии Гельмгольца, как критерия направления химического процесса?
8) Как определить направление процесса по значению энергии Гиббса? По изменению значения энергии Гиббса?
Задание для самоконтроля
1) Вычислить изменение энергии Гиббса для реакции окисления оксида серы (IV): 2SO2(г)+O2(г)→2SO3(г) при стандартных условиях, используя следующие справочные данные:
| SO2(г) | O2(г) | SO3(г) | |
| ΔH0, кДж/моль | -267 | 0 | -396 |
| ΔS0, Дж/моль*К | 248 | 205 | 257 |
Ответ: -202 кДж.
2) Рассчитать ΔH0 химической реакции Na2O(т)+H2O(ж)→2NaOH(т). Стандартные энтальпии образования Na2O(т), H2O(ж), NaOH(т) равны соответственно -416, -286 и -247,8 кДж/моль.
Ответ: -153,6 кДж.
5.2 Основы химической кинетики
С помощью законов термодинамики можно определить тепловой эффект реакции и направление её протекания. Но для определения такой важной характеристики, как скорость химической реакции потребуется инструмент другого раздела физической химии – химической кинетики. Вопрос о скорости химической реакции вовсе не является праздным для человечества. Скажем, процесс горения, на котором основана современная цивилизация (а этот процесс протекает в моторах машин, кораблей, самолетов, печах тепловых и электростанций) – это химическая реакция, протекающая с большой скоростью. А химические процессы, протекающие с еще большей скоростью – это взрывы. На их основе сейчас тоже пытаются создать двигатели – детонационные [33].
Итак, химическая кинетика – раздел химии, изучающий скорости и механизмы химических реакций. Все химические реакции можно поделить на две большие группы:
Химическая реакция может протекать внутри одной фазы, то есть, внутри гомогенной системы. Раз свойства фазы либо одинаковы во всем объеме фазы, либо меняются плавно, без скачка, то и химическая реакция будет протекать во всем объеме этой фазы, примерно с одинаковой скоростью. Самый банальный пример таких реакций – реакции ионного обмена, которые протекают в растворах. Такие химические реакции, протекающие в одной фазе, называются гомогенными.
Однако, химическая реакция может протекать и между двумя фазами термодинамической системы. Так как фазы отделены друг от друга границей раздела, то именно на ней и будет протекать химическая реакция, на границе между двумя фазами, на том месте, где два исходных вещества касаются друг – друга. Например, полено в печке не горит изнутри – а только там, где оно касается кислорода воздуха. Реакция протекает на границе дерево – воздух. Такие химические реакции, протекающие на границе раздела фаз, называются гетерогенными.
Подходы к описанию гетерогенных и гомогенных реакций существенно отличаются. Если в гомогенной системе частицам для запуска химической реакции нужно столкнуться друг с другом, то в случае гетерогенной реакции частицам потребуется:
1) Добраться до границы раздела фаз.
2) Прореагировать друг с другом.
3) Продукт реакции должен покинуть границу раздела фаз.
Это упрощенный набор стадий гетерогенной реакции. И каждая из этих стадий описывается своими законами. Поэтому, нет ничего удивительного в том, что единицы измерения скорости гомогенных и гетерогенных реакций отличаются. Скорость химической реакции (V, U) – это изменение количества вещества одного из реагирующих вещества в единицу времени в единице объема (если реакция гомогенная) или число элементарных актов взаимодействия в единицу времени на единицу поверхности раздела фаз (если реакция гетерогенная). Соответственно, в случае гомогенной реакции её скорость будет измеряться в  , а в случае гетерогенной в
, а в случае гетерогенной в 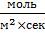 .
.
По мере того, как протекает химическая реакция, уменьшается концентрация исходных веществ, а, значит, всё меньше и меньше частиц будут взаимодействовать друг с другом. Чем меньше количество взаимодействий – тем ниже скорость реакции. Поэтому выделяют два способа выражения скорости химической реакции:
· мгновенная (истинная) скорость реакции
· средняя скорость реакции
Мгновенная скорость реакции – это скорость реакции в некоторый момент времени. Так как количество исходных веществ в химической реакции постоянно уменьшается, то мгновенная скорость реакции так – же уменьшается, и в каждый момент времени у химической реакции свое значение мгновенной скорости. Средняя скорость химической реакции – это изменение количества вещества за некоторый промежуток времени. Разница между мгновенной и средней скоростями реакции легко демонстрируется на банальном примере. Машина из одного города до другого идет 4 часа, расстояние между городами 300 километров. Большую часть дороги машина шла со скоростью 90 км/ч, на автомагистрали со скоростью 110 км/ч, а где-то дорога в плачевном состоянии, и ехать со скоростью более 60 км/ч запрещено. Дважды машина останавливалась – на заправке и у столовой, в эти моменты времени скорость была равна 0км/ч. Эти значения скоростей – мгновенные, а среднее значение составляет 300км/4ч = 75 км/ч.
Для определения мгновенной скорости реакции строится график зависимости концентрации либо исходного вещества, либо продукта реакции от времени реакции (рисунок 5.1):
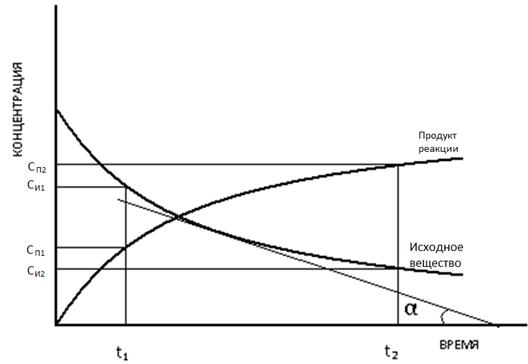
Рисунок 5.1. Зависимость концентраций исходного вещества и продукта от времени.
Для определения мгновенной скорости реакции в некоторый момент времени к графику прокладывается касательная. Тангенс угла α будет равен мгновенной скорости реакции:
Uист = dС/dt = tg α
Средняя скорость реакции высчитывается как отношение изменения концентрации (ΔС=C2-С1) к промежутку времени (Δt=t2-t1):
Uср = ΔС/ Δt
Так как концентрация продукта растет, а исходного вещества уменьшается результат вычисления, в случае необходимости, умножается на -1, т.к. скорость химической реакции всегда положительна.
Скорость химических реакций зависит от нескольких факторов:
1) Природа химических веществ, участвующих в реакции.
2) Концентрация реагирующих веществ.
3) Температура
4) Присутствие катализатора.
В частных случаях возможно влияние и других факторов. Если в реакции участвую газы, то на скорость химической реакции будет влиять давление. Если реакция протекает в растворе, то влияние будет оказывать природа растворителя, в реакциях межфазного катализа на скорость реакции влияет интенсивность перемешивания и т.д.
Продемонстрировать влияние природы веществ на скорость химической реакции можно на примере реакций окисления кислородом воздуха некоторых веществ:
2H2 + O2 ® 2H2O
C+O2 ® CO2
4Fe + 3O2 ® 2Fe2O3
В первом случае реакция протекает со взрывом, именно она стала причиной трагедии дирижабля «Гинденбург». 190 000 м3 водорода сгорели примерно за полминуты [34]. Вторая реакция описывает горение углерода (угля), третья – процесс окисления железа, который растягивается на годы.
Зависимость скорости химической реакции от концентраций реагирующих веществ описывается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции. То есть, для реакции, в которой участвуют a моль вещества A и b моль вещества В: aA+bB→cC+dD Скорость химической реакции будет высчитываться по формуле 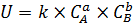 . Где СA и CB – концентрации веществ A и B, a и b – степени, в которые возводятся соответствующие концентрации, k – константа скорости химической реакции. Для понимания смысла такого показателя, как константа скорости химической реакции, нужно посмотреть на математическое выражение закона действующих масс. Если концентрации всех веществ будут равны 1 моль/л то результат перемножения всех концентраций тоже будет равен 1, ведь 1x=1, при любом х. Следовательно, если концентрации всех веществ равны 1 моль/л получается, что скорость химической реакции равна константе U=k. Таким образом, константа скорости химической реакции – это скорость химической реакции, при концентрациях всех исходных веществ в 1 моль/л. Константа скорости химической реакции зависит от тех – же самых факторов, что и скорость химической реакции:
. Где СA и CB – концентрации веществ A и B, a и b – степени, в которые возводятся соответствующие концентрации, k – константа скорости химической реакции. Для понимания смысла такого показателя, как константа скорости химической реакции, нужно посмотреть на математическое выражение закона действующих масс. Если концентрации всех веществ будут равны 1 моль/л то результат перемножения всех концентраций тоже будет равен 1, ведь 1x=1, при любом х. Следовательно, если концентрации всех веществ равны 1 моль/л получается, что скорость химической реакции равна константе U=k. Таким образом, константа скорости химической реакции – это скорость химической реакции, при концентрациях всех исходных веществ в 1 моль/л. Константа скорости химической реакции зависит от тех – же самых факторов, что и скорость химической реакции:
· природы химических веществ, участвующих в реакции;
· температуры;
· присутствия катализатора;
· и других факторов, в частных случаях
Но от концентраций реагирующих веществ константа скорости химической реакции не зависит!
Дата добавления: 2018-04-05; просмотров: 287; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
