III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность. 9 страница

В этой ядерной реакции происходит изменение количества нуклонов в ядрах атомов. В левой части представлены изотопы азота 14 нуклонами (14N) и гелия c 4 нуклонами (4He), в правой части представлены продукты ядерной реакции – изотоп кислорода с 17 нуклонами (17O) и изотоп водорода с 1 нуклоном в ядре (1H). Из этой записи видно, что происходит изменение количества нуклонов в ядрах взаимодействующих атомов, следовательно, это ядерная реакция.
Итак, в химических реакциях одно вещество превращается в другое. Вещество можно описать его химической формулой, поэтому описание процесса химического превращения тоже может быть сведено к символьной записи – химическому уравнению. В левой части уравнения указываются исходные вещества в виде соответствующих химических формул. Поскольку запись представляет собой именно уравнение, то эти формулы перечисляются через знак «+». В правой части химического уравнения аналогичным образом, с помощью химических формул перечисляются через знак «+», приводятся продукты реакции. Перед формулами веществ указывается количество частиц, вступивших в реакцию, единица, как обычно, опускается. Эти числа, показывающие в каком количественном соотношении вещества вступают в реакцию, называются стехиометрическими коэффициентами. Левая часть химического уравнения от правой отделяется несколькими знаками:
1) Zn + 2HCl → ZnCl2 + H2 здесь использован знак «→», это значит, что реакция протекает необратимо, заставить продукты реакции превратиться в исходные вещества крайне сложно, если не невозможно. Примерно, как выдавленную из тюбика зубную пасту пытаться поместить обратно.
|
|
|
2) N2+3H2D2NH3 здесь использован знак «D», это значит, что реакция обратима, как исходные вещества превращаются в продукты, так и продукты превращаются в исходные вещества. Поэтому такую реакцию можно записать как слева направо, так и наоборот, справа налево:
N2+3H2D2NH3 2NH3D N2+3H2
3) 4NH3(г)+3O2(г) = 2N2(г)+6H2O(ж), Q=1531 кДж; это так называемое термохимическое уравнение. В нем, помимо участвующих веществ указаны их агрегатные состояния(нижние индексы в скобках) и тепловой эффект реакции (Q=1531 кДж). Таким образом, это химическое уравнение описывает не только материальный баланс (равенство количества атомов в левой и правой частях уравнения) но и энергетический баланс (в реакции выделяется определенное количество тепла). В этой записи левая часть действительно равна правой части, по материи и энергии. Значит, в этом случае между левой и правой частью нужно поставить знак равенства «=». Эти правила, к сожалению, выполняются не во всех учебниках, во многих классических учебниках вместо этих знаков во всех случаях стоит равенство [9]. Это связано с ограниченными возможностями в печати различных издательств того времени.
|
|
|
Над символом, разделяющим левую и правую часть, могут быть указаны условия, которые требуются для протекания реакции. Это могут быть химические формулы катализаторов, отличное от атмосферного давление (p), отличная от комнатной температура (t). Например, реакция синтеза аммиака в лабораторных условиях проводится при нагревании и присутствии катализатора – оксида железа (III):
N2+3H2 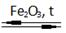 2NH3
2NH3
Дополнительно в уравнениях после формулы вещества могут присутствовать стрелки вверх (↑) и вниз (↓). Стрелка вниз указывает, что вещество в данной среде не растворяется и выпадает в осадок, а стрелка вверх отмечает газ, выделяющийся в реакции. Так, в первом примере выделяется газ – водород, его можно пометить соответствующим символом:
Zn + 2HCl → ZnCl2 + H2↑
Теперь попробуем определить количество молекул в химическом уравнении, пользуясь только их формулами. Допустим, химическое уравнение должно описывать взаимодействие сульфата алюминия и гидроксида натрия:
Al2(SO4)3+NaOH→Al(OH)3 + Na2SO4
Эта запись не является химическим уравнением, поскольку левая часть не равна правой. Это так называемая схема химической реакции. Схема химической реакции может сокращаться в различной степени, вплоть до указания исходного вещества в левой части и основного продукта в правой. Для превращения этой записи в химическое уравнение нужно расставить стехиометрические коэффициенты. Алгоритм тут простой:
|
|
|
1) Выбираем любой химический элемент, который в левой и правой части входит только в одно вещество. В данном случае это могут быть Al, Na, S. Допустим, мы выбрали Al.
2) Определяем количество атомов выбранного элемента в левой и правой частях уравнения. В левой части 2 атома алюминия, в правой 1:
Al2(SO4)3+NaOH→Al(OH)3 + Na2SO4
3) Определяем НОК между этими числами и делим их на количество атомов выбранного элемента в молекуле. Так, НОК между 1 и 2 равно 2. Значит, и в левой, и в правой части должно быть 2 атома алюминия. В левой части алюминий входит в состав молекулы Al2(SO4)3, которая содержит 2 атома алюминия, делим НОК на количество атомов в молекуле 2/2=1 и получаем стехиометрический коэффициент перед молекулой сульфата алюминия – 1, которая в записи уравнения опускается. Аналогично, в правой части в молекуле гидроксида алюминия один атом алюминия, значит, таких молекул должно быть НОК/количество атомов=2/1=2.
|
|
|
Al2(SO4)3+NaOH→2Al(OH)3 + Na2SO4
4) Теперь воспользуемся этими коэффициентами и определим количество атомов серы. В левой части три атома серы Al2(SO4)3. В правой части в молекуле сульфата натрия 1 атом серы Na2SO4. НОК между 3 и 1 = 3, следовательно, в левой части 3 молекулы сульфата натрия:
Al2(SO4)3+NaOH→2Al(OH)3 + 3Na2SO4
5) Аналогичным образом определяется количество атомов натрия. В левой части 1, в правой 6 (3Na2SO4). Следовательно, в левой части 6 молекул NaOH:
Al2(SO4)3+6NaOH→2Al(OH)3 + 3Na2SO4
Все, коэффициенты в уравнении установлены. Иногда, если выбор элемента оказался неудачным, требуется корректировка полученного коэффициента в процессе подбора. Если начать подбор с натрия, то сначала мы придем к 2 перед NaOH:
Al2(SO4)3+2NaOH→Al(OH)3 + Na2SO4
Вторым шагом установим количество атомов серы и придем к тому, что в правой части не одна молекула Na2SO4, а три:
Al2(SO4)3+2NaOH→Al(OH)3 + 3Na2SO4
Тогда придется вернуться к натрию в левой части и скорректировать коэффициент перед гидроксидом натрия:
Al2(SO4)3+62NaOH→Al(OH)3 + 3Na2SO4
И все встанет на свои места: Al2(SO4)3+6NaOH→2Al(OH)3 + 3Na2SO4
Этот метод подбора коэффициентов является самым простым. В процессе подбора нужно помнить две вещи. Во-первых, как показывает практика, в процессе подбора коэффициентов путают стехиометрические коэффициенты и индексы в формулах:
· Стехиометрические коэффициенты в уравнении показывают количество молекул вещества, вступивших в реакцию:
Al2(SO4)3+6NaOH→2Al(OH)3 + 3Na2SO4
· Индексы в химических формулах указывают количество атомов в одной молекуле, они не меняются в процессе подбора стехиометрических коэффициентов!
Al2(SO4)3+6NaOH→2Al(OH)3 + 3Na2SO4
Во-вторых, в результате подбора коэффициентов в химическом уравнении могут появляться дробные значения. В таком случае, они умножаются до целых чисел, так как в химическую реакцию не может вступить часть молекулы, молекула по определению является наименьшей частицей вещества.
Так как эталоном количества участвующих частиц является моль, то химическое уравнение можно прочитать двумя способами:
Al2(SO4)3+6NaOH→2Al(OH)3 + 3Na2SO4
· Одна молекула сульфата алюминия (Al2(SO4)3) взаимодействует с шестью молекулами гидроксида натрия (6NaOH), при этом образуется две молекулы гидроксида алюминия (2Al(OH)3) и три молекулы сульфата натрия (3Na2SO4).
· Один моль сульфата алюминия (Al2(SO4)3) взаимодействует с шестью молями гидроксида натрия (6NaOH), при этом образуется два моль гидроксида алюминия (2Al(OH)3) и три моля сульфата натрия (3Na2SO4).
Таким образом, химическое уравнение включает в себя не только перечень реагирующих веществ, но еще и информацию о том, в каком численном соотношении вещества вступают в реакцию. Поэтому, пользуясь этой записью, можно определить массы всех участников реакции. Допустим, в эту реакцию вступило 0,5 моля сульфата алюминия. Тогда, для перевода этой величины в привычные граммы необходимо количество вещества умножить на молярную массу: m(вещества) = n(вещества)×M(вещества). Молярная масса сульфата алюминия численно равна сумме относительных атомных масс атомов, которые входят в состав молекулы: M(Al2(SO4)3) = 2Ar(Al)+ 3Ar(S) +12 Ar(O) = 2×27+3×32+12×16 = 342 г/моль. Отсюда масса сульфата алюминия m(Al2(SO4)3) = n(Al2(SO4)3)×M(Al2(SO4)3) = 0,5 моль × 342 г/моль = 171 г. Теперь найдем количество вещества NaOH. По уравнению реакции видно, что Al2(SO4)3 и NaOH реагируют в соотношении 1 к 6. Следовательно, раз количество вещества Al2(SO4)3 0,5 моль, то количество вещества NaOH должно составлять 3 моля. Молярная масса NaOH: M(NaOH) = Ar(Na)+Ar(O)+Ar(H) = 23+16+1 = 40 г/моль. Тогда его масса m(NaOH) = n(NaOH)×M(NaOH) = 3 моль × 40 г/моль = 120 г. Гидроксид алюминия (Al(OH)3) в этой реакции образуется в отношении к Al2(SO4)3 как 2 к 1. Значит, его количество вещества – 1 моль. Его молярная масса: M(Al(OH)3) = Ar(Al)+3Ar(H)+3Ar(H)=27+3×16+3×1=78 г/моль. Его масса m(Al(OH)3) = n(Al(OH)3)×M(Al(OH)3)=1 моль×78 г/моль=78 грамм. Ну, и наконец, количество вещества сульфата натрия (Na2SO4), который образуется в отношении к Al2(SO4)3 как 3 к 1 составляет 1,5 моля. Молярная масса сульфата натрия: M(Na2SO4) = 2Ar(Na)+Ar(S)+4Ar(O)=2×23+32+4×16= 142 г/моль. Тогда его масса m(Na2SO4) = n(Na2SO4)×M(Na2SO4)=1,5 моля×142 г/моль=213 грамм.
Эти вычисления легко проверяются. Согласно закону сохранения масс сумма масс исходных веществ должна быть равна сумме масс продуктов. Проверим, сумма масс исходных веществ: 171г+120г=291 грамм. Сумма масс продуктов 78г+213г=291 грамм. Совпадение? Нет, закон сохранения масс в действии.
Вопросы для самоконтроля
1. В чем смысл закона Дальтона?
2. В чем смысл понятия валентность?
3. Как выглядит химическая формула, и какой смысл она несет?
4. Чем отличаются обычные химические формулы от структурных? В каких случаях они используются?
5. Что такое химическое уравнение? Что обозначают стехиометрические коэффициенты в нём и символы между левой и правой частью?
6. Какие дополнительные символы могут встретиться в химическом уравнении?
Задания для самоконтроля
1. Расставить коэффициенты в химических уравнениях:
Fe3(PO4)2+KOH→Fe(OH)2+K3PO4
HCl+Ca(OH)2→CaCl2+H2O
CaCl2 + AgNO3 →Ca(NO3)2 + 2AgCl
2. Рассчитать массу гидроксида железа Fe(OH)2 в первом уравнении, если известно, что в реакцию вступил 1 моль KOH. (Ответ: 45 грамм)
3. Рассчитать массу воды H2O во втором уравнении, если известно, что в реакцию вступило 2 моля HCl. (Ответ: 18 грамм)
4. Рассчитать массу нитрата кальция Ca(NO3)2, если известно, что в реакцию вступило 111 грамм хлорида кальция (CaCl2). (Ответ: 164 грамма)
Глава 5. Основы химической термодинамики и химической кинетики.
5.1. Основы термодинамики.
Термодинамика и кинетика подробно изучаются в курсе физической химии, так как их понимание требует от студента владения инструментами высшей математики, например дифференцирования. Поэтому в рамках курса общей химии термодинамика и кинетика рассматриваются на уровне основ.
Химическая термодинамика – это раздел химии, который изучает взаимные превращения различных видов энергии в зависимости от условий протекания процесса, а также направление и пределы самопроизвольного протекания химических реакций при заданных условиях. Впервые с термодинамикой школьник сталкивается в 10 классе в курсе физики [30, 31] и знакомится с циклом Карно, принципами работы и видами тепловых машин и т.д. Однако, химиков интересуют иные, частные вопросы: какое количество тепла выделится при протекании такой-то реакции, какая температура необходима для её запуска, и возможна – ли такая реакция в принципе. Поэтому, когда речь идет о частных, химических, вопросах используется инструмент химической термодинамики. Хотя основы у неё те – же самые.
Объект изучения химической термодинамики называется термодинамической системой. Система это мысленно или фактически отделенное от окружающей среды тело или группа тел, состоящее из множества взаимодействующих друг с другом частиц. Ключевая часть этого определения – из множества частиц. Термодинамические величины определяются не природой изучаемых частиц, а их громадным количеством в системе. Если для одной частицы (электрона, молекулы) движение можно предсказать, исходя из каких-то исходных условий (масса частицы, её заряд, внешнее магнитное поле и т.д.) то когда в одной системе этих частиц содержатся моли – такие расчеты становятся бессмысленными. Движение частиц становится неупорядоченным, хаотичным. Скажем, средняя молекула воздуха за секунду сталкивается с соседями 5 миллиардов (5 000 000 000) раз. Поэтому приходится рассматривать термодинамическую систему в целом, как макрообъект, свойства которого обусловлены гигантским количеством взаимодействий его составляющих. Рассмотрим такое понятие как температура. Температура это средняя энергия поступательного движения молекул [32]. Температура является результатом взаимодействия громадного количества частиц, их столкновений. Причем, совершенно не важно, какие именно это частицы. Отсюда становится очевидным, что измерять температуру одной молекулы не имеет смысла. Это характеристика макроскопического объекта – термодинамической системы. Собственно, именно из-за того, что исчезает зависимость свойств макрообъекта от вида его составляющих, термодинамические подходы используются для описания множества процессов. Химические системы – лишь частный случай термодинамических.
В зависимости от того, может – ли система обмениваться веществом и энергией с окружающей средой выделяются три вида термодинамических систем:
· Системы, которые не могут обмениваться с окружающей средой ни энергией, ни веществом называются изолированными.
· Системы, которые могут обмениваться с окружающей средой энергией, но не могут обмениваться веществом, называются закрытыми.
· Системы, которые могут обмениваться с окружающей средой и энергией и веществом называются открытыми.
Тут может возникнуть вопрос – а почему нет системы, которая могла – бы обмениваться с окружающей средой веществом, но не энергией? Ответ очень прост. Вещество является носителем энергии. И даже если опустить температуру до недостижимого абсолютного нуля (-273,150С), обнулив энергию хаотического движения, все равно останется энергия ядерных сил. Поэтому, система, обмениваясь веществом, обменивается и энергией, заключенной в этом веществе.
Следующее понятие – фаза. Фаза – это часть термодинамической системы, которая отделена от других частей границей раздела фаз и сильно отличается от них своими свойствами и строением. При этом изменение свойств внутри одной фазы происходит равномерно, без резких скачков. Например, можно нагреть середину металлической проволоки. Тогда её концы и середина будут обладать разными температурами, но при переходе от горячей середины к холодному концу температура будет равномерно падать. Эта проволока по-прежнему является одной фазой, так как при нагревании не возникло границы раздела фаз и свойства изменились без скачка. Но если часть проволоки расплавить, то тогда возникнет граница раздела фаз – между расплавленным металлом и проволокой, и такие свойства, как плотность, вязкость при переходе от кристалла к расплаву резко изменятся. В данном примере система становится двухфазной. Если термодинамическая система состоит из одной фазы, то она называется гомогенной. Если термодинамическая система состоит из нескольких фаз, то она называется гетерогенной. Свойства гомогенных и гетерогенных систем сильно отличаются не только потому, что в гетерогенных системах несколько различных фаз, но еще и потому, что граница раздела фаз тоже обладает особыми свойствами. В некоторых случаях её даже рассматривают как отдельную фазу. Но это более подробно рассматривается в курсе коллоидной химии.
Для описания некоторого состояния системы с позиций термодинамики нужно знать некоторое количество её параметров, которые связаны между собой каким-либо математическим выражением – уравнением состояния. Например, для идеального газа это уравнение Менделеева-Клайперона:
PV=νRT
Соответственно, его второе название – уравнение состояния идеального газа. Параметры, которые входят в уравнение состояния называются функциями состояния. Так, в уравнении состояния идеального газа входит 4 функции состояния: давление (P), объем (V), температура (T), количество вещества (ν). R – универсальная газовая постоянная, её значение не меняется, поэтому она не является функцией состояния. Количество функций состояния, знание которых необходимо для расчета всех остальных называется числом степеней свободы. Для уравнения состояния идеального газа потребуется знание трёх функций состояния, для расчета четвертой:
Дата добавления: 2018-04-05; просмотров: 250; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
