III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность. 13 страница
Таким образом, ориентируясь на значение концентраций, можно отличить обратимую реакцию от необратимой. В результате необратимой реакции одно и исходных веществ будет полностью израсходовано, а в результате обратимой реакции концентрации всех веществ установятся на некоторых постоянных значениях. Однако, пользуясь только постоянством концентраций можно столкнуться с так называемым ложным равновесием. В состоянии ложного равновесия концентрации веществ постоянны из-за того, что химическая реакция по каким-то причинам не идет. Отличить такое состояние от истинного равновесия достаточно легко – нужно поменять внешние условия. Если система находилась в состоянии ложного равновесия, то запустится необратимая химическая реакция, в процессе которой одно из исходных веществ израсходуется до конца. Это можно проиллюстрировать следующим примером: допустим, у удачливого пирата скопился клад с золотом. Как и положено классическому книжному пирату, он закапывает клад на необитаемом острове. Потом выясняется, что пират не настолько удачлив, и клад остается в земле. Спустя пару столетий, на этот остров приходит студент-химик и заявляет: «Концентрация золота в земле не менялась два столетия, поэтому эта система находится в состоянии равновесия». Студент неправ, так как концентрация золота в земле не менялась из-за его химической стойкости. Золото просто не вступало в химическую реакцию. Это и есть состояние ложного равновесия. В истинном равновесии всегда протекает двусторонняя, обратимая химическая реакция.
|
|
|
Так как химическое равновесие является частным случаем термодинамического, то существует связь между энергией Гиббса и константой равновесия:
ΔG = - R×T×lnK
где R – универсальная газовая постоянная (8,31 Дж/(моль∙К)); Т – абсолютная температура, К; К – константа равновесия.
Приведенное уравнение позволяет по величине ΔG вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов. Если:
• K > 1, то ΔG < 0, в равновесной смеси преобладают продукты взаимодействия, протекает преимущественно прямая реакция;
• K < 1, то ΔG > 0, в равновесной смеси преобладают исходные вещества, протекает преимущественно обратная реакция;
• K = 1, то ΔG = 0, скорости прямой и обратной реакций равны между собой, система находится в состоянии химического равновесия.
Так как константа химической реакции зависит от внешних условий, то при их изменении произойдет и изменение равновесных концентраций. Такое изменение называется смещением химического равновесия. То есть, смещение химического равновесия – это переход от одного равновесного состояния к другому. В зависимости от того, в какую сторону смещается равновесие, выделяют смещение «влево» и «вправо», соответственно имеется в виду увеличение скорости обратной (тогда растут равновесные концентрации исходных веществ) и прямой (тогда растут концентрации продуктов) реакций. Это обозначение условно, поскольку любою равновесную реакцию можно записать как слева направо, так и наоборот:
|
|
|
I2(г) + Н2(г) D 2HI(г)
2HI(г) D I2(г) + Н2(г)
Влияние внешних условий на положение равновесия описывается принципом Ле Шателье - Брауна: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. Этот принцип можно немного перефразировать для лучшего понимания: при воздействии на систему, находящуюся в равновесии, она будет стремиться перейти в такое равновесное состояние, в котором эффект внешнего воздействия будет минимальным.
Влияние изменения температуры определяется тепловым эффектом реакции. Если реакция эндотермическая (протекает с поглощением теплоты, ΔH>0), то увеличение температуры увеличит скорость прямой реакции (равновесие сместится вправо), а уменьшение температуры увеличит скорость обратной реакции (равновесие сместится влево). Так как прямая реакции идет с поглощением теплоты, то если к системе подвести дополнительное тепло (увеличить температуру), увеличится константа скорости прямой реакции, что и вызовет смещении равновесия вправо. Если реакция экзотермическая (протекает с выделением теплоты, ΔH<0), то увеличение температуры увеличит скорость обратной реакции. Так как в результате прямой реакции тепло выделяется, то в этом случае, прямая реакция будет ускоряться, если осуществлять отвод тепла (понизить температуру). Например, реакция окисления оксида углерода (II) является экзотермической, поэтому увеличение температуры сместит равновесие влево:
|
|
|
2CO + O2 D 2CO2, ΔH < 0
ß увеличение температуры
уменьшение температуры à
Если произойдет изменение концентрации одного из реагирующих веществ, то по закону действующих масс концентрации перераспределятся таким образом, что – бы их отношение снова стало равным константе химической реакции:
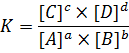
Если увеличить концентрацию продукта D, то равновесие сместиться в сторону его расходования, так как возрастет скорость обратной реакции, если наоборот, его концентрацию уменьшить, то скорость обратной реакции упадет, и равновесие сместится вправо. То есть, при увеличении концентрации одного из веществ равновесие сместится в сторону его расходования, а при уменьшении концентрации – в сторону его образования.
|
|
|
Изменение давления оказывает влияние на равновесную систему в том случае, если в реакции участвуют газы. Чем больше в реакции образуется газа, тем больший он будет занимать объем. Если увеличивать давление, то системе будет невыгодно большое количество газа, и равновесие сместиться в сторону его расходования. Однако, если суммарное количество частиц газа в левой и правой части химического уравнения обратимой реакции одинаково, то изменение давления не окажет влияния на состояние равновесия. Если в реакции участвуют газы, то увеличение давления сместит равновесие в ту сторону, в которой газов образуется меньше, а уменьшение давления сместит равновесие в сторону образования большего количества газов. Например, в приведенной выше реакции все вещества являются газами, в левой части 3 моль газа, в правой 2.
2CO + O2 D 2CO2
ß уменьшение давления
увеличение давления à
Поэтому, увеличение давления вызовет смещение равновесия вправо, а уменьшение сместит равновесие влево.
Вопросы для самоконтроля
1) Что такое химическое равновесие? Как его отличить от ложного равновесия?
2) Что такое константа равновесия, от каких факторов она зависит?
3) В чем заключается принцип Ле Шатлье – Брауна?
4) Как повлияет на константу равновесия изменение концентрации одного из веществ? Как он повлияет на состояние равновесия?
5) Почему ввод катализатора не оказывает влияния на состояние равновесия?
6) Как изменится положение равновесия реакции синтеза аммиака N2+3H2D2NH3 ΔH<0, увеличение температуры и давления? Как изменится ответ, если реакцию записать следующим образом: 2NH3D N2+3H2? Что произойдет, если увеличить концентрацию водорода?
Глава 6. Дисперсные системы.
6.1 Дисперсные системы. Растворы.
В 1й главе, в процессе рассуждения о термине вещество, под которым химиками понимается индивидуальном вещество, 100% чистое вещество, был сформирован вывод о том, что такое состояние является принципиально недостижимым, это абстракция. Ни один, даже самый совершенный метод разделения веществ не сможет выделить 100% частиц одного вещества, это невозможно, исходя из второго закона термодинамики. Ведь создание 100% чистого вещества – это процесс, который увеличивает степень упорядоченности, уменьшает энтропию (к слову, это можно сравнить с уборкой в комнате, только вот для понимания масштабов задачи нужно попытаться выбить абсолютно все частички пыли из коврика). Поэтому, на практике приходится иметь дело не с абсолютно чистыми веществами, а с некоторыми их смесями. Эти смеси, то есть системы, в которых одно или несколько веществ в виде мелких частиц распределены в другом веществе, называют дисперсными. В дисперсных системах можно выделить дисперсионную среду и дисперсные фазы:
· Дисперсионная среда – вещество, образующее сплошную непрерывную фазу, в которой происходит распределение другого вещества в виде раздробленных частиц того или иного размера.
· Дисперсная фаза - вещество, которое распределяется в дисперсионной среде.
В зависимости от нужд исследователя, все дисперсные системы можно классифицировать по двум признакам: по размеру частиц дисперсной фазы, и по агрегатному состоянию дисперсионной среды и дисперсной фазы.
В рамках первой классификации, по размеру частиц дисперсной фазы дисперсные системы делятся на истинные растворы, коллоидные растворы и грубодисперсные системы.
1. Истинные растворы. Размер частиц меньше 10-9 м. В истинных растворах степень «дробления» вещества соответствует размерам молекул (ионов), следовательно, исчезает граница раздела между дисперсионной средой и дисперсной фазой. Такая система является однородной, гомогенной.
2. Коллоидные растворы. Размер частиц составляет от 10-9 до 10-7 м. В таких системах размер частиц распределенного вещества позволяет им существовать в виде отдельной фазы. Причем, из-за маленького размера эти частицы создают гигантскую по площади границу раздела фаз[2]. Эти два фактора – размер частиц, сопоставимый с длиной видимого человеком излучения и гигантская площадь границы раздела фаз придает коллоидным системам особые свойства. Например, рассеивание света, из-за которого небо кажется нам голубым, а закат и рассвет красными, ведь атмосфера Земли тоже является коллоидным раствором. Подробно свойства коллоидных растворов изучаются в курсе коллоидной химии.
3. Грубодисперсные системы. Размер частиц больше 10-7 м. Размер частиц внутри грубодисперсных систем настолько велик, что позволяет рассматривать их как гетерогенные системы, где свойства каждой фазы аналогичны свойствам индивидуального вещества. Как правило, большой размер частиц способствует их дальнейшему слипанию и последующему осаждению - коагуляции, поэтому грубодисперсные системы неустойчивы, их ΔG образования положительна, и для их существования приходится прилагать внешнее воздействие (например, перемешивание).
Второй способ классификации удобно представить в виде таблицы (таблица 6.1). Из неё становится понятно, что привычные для работы водные растворы – лишь малая часть огромного многообразия дисперсных систем. Строго говоря, эта таблица является неполной, так как в ней отсутствует четвертое агрегатное состояние вещества – плазма, однако такие объекты изучаются в большей степени физикой, нежели химией.
Частным случаем дисперсных систем являются растворы – многокомпонентные однофазные системы переменного состава. Этот тип систем очень широко используется в химии, так как химические реакции, протекающие в растворах, обычно идут с большой скоростью, легко описываются, а их ход можно контролировать. И, как видно из таблицы 6.1 растворы не всегда являются жидкостями. Раствор может быть образован газами, или твердыми телами.
Таблица 6.1. Классификация дисперсных систем по агрегатному состоянию дисперсионной среды и дисперсной фазы
| Дисперсионная среда | Дисперсная фаза | Примеры |
| Газ | Газ | Газовые смеси |
| Жидкость | Туманы, облака | |
| Твердое тело | Пыль, дым | |
| Жидкость | Газ | Пена |
| Жидкость (несмешивающиеся жидкости) | Эмульсии (молоко, крема, нефть) | |
| Твердое тело (нерастворимое в данной жидкости) | Суспензии, взвеси (глина в воде) | |
| Твердое тело | Газ | Твердые пены (пенопласты, пемза, пеностекло) |
| Жидкость | Твердые эмульсии (вода в парафине, жемчуг) | |
| Твердое тело | Сплавы, твердые растворы |
Для описания раствора принято использовать такие понятия, как растворитель и растворенное вещество. Однако, эти понятия в некоторых случаях становятся бессмысленными. Казалось – бы, все настолько очевидно, что, даже в школьном учебнике химии Рудзитиса в главе, посвященной растворам, термину растворитель не дано определения, есть только отсылка к учебнику природоведения[1]. Тем не менее, как можно отличить растворитель от растворенного вещества? Первая мысль, о том, что растворителя всегда больше, чем растворенного вещества оказывается неверной. Например, в 100 граммах воды можно растворить 300 грамм нитрита калия (KNO2). Второй признак – сохранение своего агрегатного состояния и строения, если водный раствор нитрита калия жидкий, и из двух исходных веществ – воды и соли – именно вода является жидкостью, то она и должна быть растворителем. Но и этот признак работает не всегда. При попытке смешать две плохо смешивающиеся жидкости, например, воду и бензин, на их границе раздела образуются два раствора – раствор воды в бензине и раствор бензина в воде. Есть еще один признак, который приводится в учебниках высшей школы [36]. Вещества растворяются друг в друге до некоторых пределов. По достижении этого предела новая порция вещества не будет переходить в раствор, не будет растворяться. Поэтому растворителем можно считать то вещество, добавление которого к раствору не вызовет насыщения. Так воду к раствору нитрита калия можно прибавлять бесконечно, а вот нитрит калия по достижении некоторой концентрации растворяться перестанет. Казалось – бы, вот он, верный признак растворителя, но нет. Есть вещества, которые неограниченно растворяются друг в друге, например вода и спирт. И снова понятия растворитель и растворенное вещество теряют свой смысл. Поэтому, определяя, какое из веществ в растворе является растворителем, а какое – растворенным веществом, следует помнить, что эти понятия являются формальными:
· Растворитель – это компонент раствора, который не меняет своих агрегатного состояния и строения при образовании раствора, и может бесконечно добавляться к раствору.
· Растворенное вещество – это компонент раствора, который может менять свое агрегатное состояние и строение при образовании раствора, а его бесконечное добавление в раствор невозможно.
Очевидно, что свойства растворов зависят от их состава, поэтому, для описания растворов необходима величина, характеризующая количественный состав раствора – концентрация растворенного вещества (или веществ). Способов выражения концентрации существует несколько, и, поскольку для различных целей используются различные способы выражения концентрации, то химик должен не только уметь ими пользоваться, но и при необходимости пересчитывать друг в друга.
Первая группа способов выражения концентраций – это доли. Доли обычно выражаются в процентах (1% - одна сотая), хотя могут быть использованы и промилле (1‰ – одна тысячная, в промилле традиционно измеряют долю алкоголя в крови человека), и безразмерные десятичные дроби. Доля показывает, какая часть некоторой характеристики раствора обусловливается присутствием растворенного вещества. В химии используются массовые (W), объемные (φ) и мольные (вариантов обозначения мольной доли довольно много: x, X, y, N, χ) доли.
Массовая доля показывает, какая часть массы раствора принадлежит растворенному веществу. Она вычисляется как соотношение масс растворенного вещества и всего раствора:
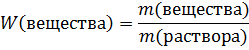
Если нужно привести ответ в процентах, то результат вычисления умножается на 100%, если в промилле – то на 1000‰. Пользуясь массовой долей можно рассчитать массу растворенного вещества, либо по известной массе вещества – массу раствора:
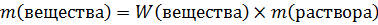
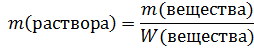
Объемная доля показывает, какая часть объема раствора принадлежит растворенному веществу. Она вычисляется как соотношение объема растворенного вещества к объему раствора:
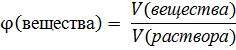
Аналогично массовой доле, через объемную долю можно вычислить объем растворенного вещества, или объем раствора. Однако, необходимо помнить, что при растворении одного вещества в другом итоговый объем раствора может отличаться от суммы объемов исходных веществ. Градусы, в которых измеряется крепость алкогольных напитков, являются объемной долей спирта.
Мольная доля показывает, какая часть частиц в растворе является частицами растворенного вещества. Она высчитывается как отношение количества частиц вещества в растворе (в молях) к количеству всех частиц в растворе:
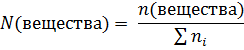
 – сумма всех частиц в растворе (в молях).
– сумма всех частиц в растворе (в молях).
Так как объем газов определяется его количеством вещества, то для газов мольная доля равна объемной: N(газ) = φ(газ).
Вторая группа способов выражения концентраций связана с количеством вещества. Это молярная концентрация (она – же молярность, С, моль/л), молярная концентрация эквивалента (она - же нормальность, Cэкв, Сн, моль-эквивалент/л, н.) и моляльность (Cm, моль/кг).
Молярная концентрация – это количество моль вещества, которое содержится в 1 литре раствора. Вычисляется как отношение количества вещества к объему раствора в литрах:
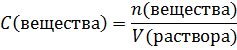
Молярная концентрация эквивалент – это количество эквивалентных частиц вещества, которое содержится в 1 литре раствора. Вычисляется как отношение количества вещества эквивалента к объему раствора в литрах:
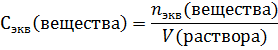
Молярную концентрацию легко перевести в молярную концентрацию эквивалента. Для этого молярность нужно поделить на фактор эквивалентности[3]:
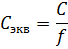
Моляльность – это количество моль растворенного вещества, которое содержится в 1 килограмме растворителя. Запомните это исключение, моляльность – это единственная концентрация, которая выражается не через параметр раствора, а через параметр растворителя. Она высчитывается как соотношение количества вещества к массе растворителя в килограммах:

И, наконец, последний способ выражения концентрации раствора – титр (Т). В быту это самый распространенный способ выражения количественного состава раствора. Титр – это масса вещества, содержащаяся в некотором объеме раствора:
Дата добавления: 2018-04-05; просмотров: 236; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
