III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность. 8 страница
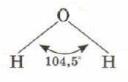
Ответ: так как центральный атом находится в состоянии sp3-гибридизации, и на двух гибридных облаках размещаются электронные пары, то молекула воды имеет угловое строение, валентный угол близок к тетраэдрическому.
Вопросы для самоконтроля
1. Что такое гибридизации?
2. Какие облака вступают в гибридизацию?
3. Каковы основные типы гибридизации?
4. Как гибридизация центрального атома влияет на форму молекулы?
Задачи для самоконтроля
1. Определить форму молекулы фосфина PH3.
Ответ: искаженный тетраэдр.
2. Определить форму молекулы хлорида бериллия BeCl2.
Ответ: линейная.
3. Определить форму молекулы хлорида бора BCl3.
Ответ: правильный треугольник.
3.3 Ионная и металлическая связи.
В начале третьей главы упоминалось о том, что химические связи, в зависимости от распределения в них электронов, обладают разными свойствами. В связи с этим, помимо рассмотренной выше, ковалентной связи, выделяют еще ионные, металлические и межмолекулярные.
Ионная связь – это связь, которая осуществляется в результате образования и электростатического взаимодействия противоположно заряженных ионов. Ионная связь образуется в том случае, если атомы, образующие химическую связь обладают сильно различающейся электроотрицательностью. Тогда общая электронная пара настолько сильно смещается к более электроотрицательному атому, что он превращается в заряженную частицу – анион, которая удерживает вокруг себя положительные частицы – катионы не столько за счет общей электронной пары, сколько за счет кулоновских сил электростатического притяжения. Из-за того, что частицы, образовавшие ионную связь, превращаются в точечные заряды, свойства ионной связи сильно отличаются от свойств ковалентной связи. Ионная связь, в противовес ковалентной, обладает свойствами ненасыщенности и ненаправленности.
|
|
|
Частицы удерживаются вместе взаимным притяжением электрических полей. И такое поле, в отличие от электронного облака, во-первых, имеет сферическую форму, а во-вторых, не компенсируется полностью соседними полями. Поэтому количество непосредственных соседей у иона может варьироваться. Это и есть свойство ненасыщаемости. Если количество соседей у атома, создавшего ковалентную связь, определяется его валентностью, и существует правило насыщаемости, обязывающее атом тратить все свой неспаренные электроны, то у ионов таких ограничений нет.
Ненаправленность тоже вытекает из свойств электрического поля иона. Это поле имеет сферическую форму. Сфера равноценна во всех направлениях, поэтому не имеет значения, с какой стороны произойдет его компенсация. В веществах с ионной химической связью нет какого-то приоритетного направления, в отличие от направленных ковалентных связей.
|
|
|
Каждый ион окружен ионами противоположного знака, причем из-за отсутствия у ионной связи направленности и насыщаемости, количество и расположение соседних противоионов различается. Поэтому вещество с ионной связью является кристаллом, который можно представить как единую гигантскую молекулу (рисунок 3.15):
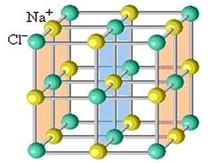
Рисунок 3.15. Модель кристалла хлорида натрия.
Забегая чуть дальше нужно отметить, что для вещества с ионной связью использование химической формулы не всегда является корректным. Так как кристалл состоит из громадного числа частиц, которые не связаны ковалентными связями, то соотношение числовых коэффцициентов в химической формуле очень велико NanClm, и так как в кристалле всегда присутствуют дефекты структуры, m и n еще и не соответствуют валентному соотношению.
Кроме того, несмотря на столь большие различия между свойствами ковалентной связи и ионной провести между ними границу не всегда возможно. Полного смещения электронной пары не происходит даже в случае максимально возможной электроотрицательнти между атомами (щелочной мета и галоген). Условно считается, что граница между ковалентной поляной и ионной связью лежит на значении эффективного заряда в 0,5 от заряда электрона. Если эффективный заряд при атомах ковалентной полярной связи более половины заряда электрона, то связь считается ионной.
|
|
|
Металлическая связь возникает в том случае, если при формировании кристалла участвуют элементы, которые легко отдают свои электроны. В результате связь формируется за счет обобществления всех валентных электронов в кристалле, а не пары электронов между двумя атомами, как при формировании обычной ковалентной связи. То есть, металлическая связь является нелокализованной, она не является собственностью пары атомов. Свойством отдавать свои электроны обладают металлы, поэтому связь характерна для этого класса веществ, и называется соответственно. Так как электронов в металлическом кристалле много, то они формируют так называемый «электронный газ», поэтому кристалл металла можно рассматривать как набор катионов металла, которые погружены в электронный газ. Из-за принципиально различной природы физические свойства кристаллов с ионной и металлической связью сильно отличаются:
|
|
|
· Электронный газ находится на гигантском электронном облаке, поэтому электроны могут легко путешествовать по такому кристаллу. Вещества с металлической связью являются хорошими проводниками электрического тока.
· По этой – же причине металлы обладают своей прочностью, ковкостью и пластичностью. Наглядный пример притчи, в которой мудрец просит переломить богатыря сначала один прутик, а потом их связку.
· Характерный металлический блеск обусловлен отражением света электронным газом, который выходит за пределы кристаллической решетки.
Вопросы для самоконтроля
1. Что такое ионная связь? В каких случаях она формируется?
2. Какими свойствами обладает ионная связь?
3. Что такое металлическая связь?
4. Что такое электронный газ? Какие свойства он придает металлической связи?
Глава 4. Химические формулы, уравнения и количественные расчеты.
Сформировав представление о том, как формируется химическая связь, что такое валентность, как обозначаются атомы различных химических элементов, можно приступить к изучению правил составления химических формул и их использовании в химических уравнениях. Для начала вернемся к закону Дальтона: если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа. Джон Дальтон на основе экспериментальных данных создал первый эталон массы атома т.н. «соединительный вес». Соединительный вес – это масса данного элемента, который вступает в реакцию с 1 граммом водорода. Если элемент с водородом не образует соединений, то тогда его соединительный вес высчитывается как массу этого элемента, соединяющуюся с 8 граммами кислорода. Например:
Ø 1 грамм водорода соединяется с 8 граммами кислорода
Ø 1 грамм соединяется с 25 граммами мышьяка
Ø 1 грамм водорода соединяется с 3 граммами углерода
Отсюда следует, что при реакции углерода и кислорода их массы должны относиться друг к другу как их соединительные веса 3 к 8. И действительно, если высчитать соотношение масс в углекислом газе (27,27% и 72,73%), то их отношение будет равным 3 к 8. Эти соотношения впервые отметил Иеремия Вениамин Рихтер между 1792 и 1802 г [29]. На его открытие не обратили внимания, из-за серьезного недостатка предложенной схемы – у нескольких элементов существует несколько соединительных весов, а кроме того, некоторые, вытекающие из этих заключений соединения не существуют. Так, например соединительный вес серы равен 8, соединительный вес кислорода тоже 8. Следовательно, массы серы и кислорода должны относиться в их соединении как 1 к 1, но это не единственный оксид серы (SO2). Существует еще один оксид (SO3), в котором соединительный вес серы 5  . С азотом еще интереснее – в аммиаке его соединительный вес 4
. С азотом еще интереснее – в аммиаке его соединительный вес 4  , и а в известных на тот момент трёх оксидах 3
, и а в известных на тот момент трёх оксидах 3  , 7 и 14! Однако, эти соединительные весы действительно относятся друг к другу в простых целочисленных отношениях. Атомные весы азота в аммиаке (NH3), и оксидах азота (NO2, NO, N2O) относятся друг к другу как
, 7 и 14! Однако, эти соединительные весы действительно относятся друг к другу в простых целочисленных отношениях. Атомные весы азота в аммиаке (NH3), и оксидах азота (NO2, NO, N2O) относятся друг к другу как 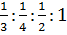 или как 4:3:6:12. Собственно, именно этот факт и отображен в еще одной формулировке закона Дальтона – если у элемента имеется несколько соединительных весов, то они относятся между собой как целые числа.
или как 4:3:6:12. Собственно, именно этот факт и отображен в еще одной формулировке закона Дальтона – если у элемента имеется несколько соединительных весов, то они относятся между собой как целые числа.
Итак, поскольку соединительные весы различных элементов соотносятся как небольшие целые числа, логично предположить, что в химических превращениях участвуют некие неделимые частицы, которые соединяются друг с другом в том – же соотношении, как простые целые числа. Причем, эти неделимые частицы обладают одинаковыми свойствами и массой (вот оно, определение атома). А раз так, то почему – бы не присвоить этим частицам условные обозначения и указывать их количество в формуле, тем самым отражая химический состав молекулы? Впервые это было продемонстрировано Дальтоном (рисунок 4.1):

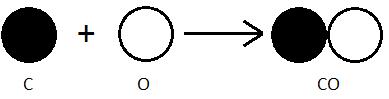
Рисунок 4.1. Символическая запись Дальтона. Под его символами указано современное обозначение атомов.
Однако так как атомы одного элемента способны присоединять к себе разное количество атомов другого элемента, то из-за этого их атомный вес непостоянен. Поэтому придётся ввести понятие валентности – это характеристика атома, отражающее кратность его атомных весов, то есть, его способность присоединять к себе разное количество атомов других элементов (это определение валентности, на которое опираются школьные учебники [1-6, 14, 15]:
масса атома = валентность × соединительный вес
Именно так были сформированы первые стехиометрические соотношения. Стехиометрия – это система законов, правил и терминов, обосновывающих расчёты состава веществ и количественных соотношений между массами (объёмами для газов) веществ в химических реакциях. Современные химические формулы похожи на символическую запись Дальтона – это символьная запись атомного состава, только элементы обозначаются латинскими символами из их названия:
NaOH – гидроксид натрия, C2H2 – ацетилен, PH3 – фосфин.
Нижний индекс после символа атома указывает на количество атомов данного элемента в молекуле. Если атом один, то единица опускается. Таким образом, в молекуле NaOH по одному атому натрия (Na), кислорода (O) и водорода. В молекуле ацетилена по 2 атома углерода (С) и водорода (H). В молекуле фосфина один атом фосфора (P) и 3 атома водорода (H).
Определенное значение, при записи химической формулы имеет и порядок перечисления атомов элементов. Для отражения строения молекулы они могут группироваться. Так в сульфате алюминия 2 атома алюминия (Al), 3 атома серы (S) и 12 атомов кислорода, но исходя из записи, которая отражает только количество атомов в молекуле, нелегко догадаться, что речь идет именно об этом веществе Al2S3O12. Гораздо удобнее сгруппировать атомы, которые входят в состав катионов и анионов с помощью скобок: Al2(SO4)3. Из этой записи уже понятно, что 2 катиона алюминия (Al) связаны с 3 сульфат-анионами (SO4), каждый из которых состоит из одного атома серы (S) и 4 атомов кислорода (O).
Химическую формулу можно вывести, зная валентность атомов химических элементов. Алгоритм следующий:
1) Описать электронную структуру атомов и определить количество неспареных электронов – валентность.
2) Определить наименьшее обще кратное между валентностями атомов (НОК). Согласно свойству насыщаемости атом обязан отдать все неспаренные электроны, таким образом, НОК – это количество химических связей в молекуле.
3) Поделить НОК на валентность. Полученный результат равен количеству атомов в молекуле. Логика тут простая, раз число связей в молекуле равно НОК, а валентность – это количество химических связей, то потребуется:
«количество атомов» = «количество связей»/«валентность»
4) Выставить получившееся количество атомов в химическую формулу нижним индексом.
В качестве примера рассмотрим оксиды углерода. В первом случае углерод находится в невозбужденном состоянии:
6C 1s2  2s2
2s2  2p2
2p2 


8O 1s2  2s2
2s2  2p4
2p4 


Отсюда, валентность и углерода и кислорода равна II. Тогда наименьшее общее кратное (количество химических связей в молекуле) равно 2. Поделим НОК на валентность углерода и определим количество его атомов в молекуле 2/II = 1. Следовательно, в молекуле оксида углерода 1 атом углерода. Аналогично для кислорода 2/II = 1. Так как единицы в формуле не указываются, то формула оксида углерода (II) CO. Во втором случае атом углерода находится в возбужденном состоянии:
6C* 1s2 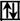 2s1
2s1  2p3
2p3 


8O 1s2 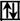 2s2
2s2 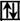 2p4
2p4 


Валентность углерода равна IV, а кислорода II. Наименьшее общее кратное равно 4. Количество атомов углерода в молекуле 4/IV=1, а атомов кислорода 4/II = 2. Отсюда, формула оксида углерода (IV) CO2.
При использовании химических формул следует помнить две вещи. Во-первых, под химической формулой не всегда скрывается сама молекула. Хорошо, если молекула образована ковалентными связями, тогда между молекулой вещества и химической формулой имеется полное соответствие, но химической формулой может быть описан и кристалл. Например, с позиций МВС валентность титана равна II, кислорода II, поэтому формула оксида титана пишется как TiO. Но реальный кристалл оксида титана может быть описан формулой от TiO0,7 до TiO1,3. Это связано тем, что в кристаллах имеются многочисленные структурные дефекты: где-то один атом под воздействием окружающее среды был вырван из кристаллической решетки, где-то один атом заменился на другой и т.д. В качестве другого примера можно привести хлорид натрия с ионной связью. Формально, с позиций МВС, формула хлорида натрия NaCl, но если посмотреть на кристаллическую решетку этого вещества (рисунок 3.15), то становится очевидным тот факт, что ион хлора окружен 6 ионами натрия. Аналогично, ион натрия окружен 6 ионами хлора. Получается, что из-за ненасыщаемости ионной связи формула хлорида натрия может быть представлена как Na6Cl6. Во-вторых, химические свойства вещества зависят не только от его атомного состава. Из одного набора атомов можно «собрать» несколько молекул, которые отличаются только последовательностью химических связей. Такие молекулы называются изомерами – молекулы, состоящие из одинакового количества атомов, но имеющие разное строение. Как было сказано в первой главе: «Химия – это конструктор с безграничными возможностями». Из набора деталей детского конструктора можно собрать модель крана, подводной лодки, самолета и т.д., использовав для этого от нескольких десятков до сотен деталей. И чем больше деталей, тем больше моделей можно собрать из такого конструктора. В молекулах органических веществ счет этих «деталей» (атомов) может достигать сотен тысяч. Поэтому одной разновидности химических формул недостаточно для описания молекул.
Структурные формулы отражают порядок соединения атомов в молекуле с помощью валентных штрихов. Так под формулой C2H6O может скрываться два вещества:

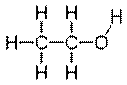
Этиловый спирт  Диметиловый эфир
Диметиловый эфир
Эти два вещества обладают сильно различающимися химическими и физическими свойствами. Небезызвестный этиловый спирт кипит при температуре примерно 780С, реагирует со щелочными металлами, а диметиловый эфир кипит при температуре -250С и не реагирует со щелочными металлами. Структурные формулы позволяют отличить один изомер от другого. Но при этом, приведенные выше полные структурные формулы станут слишком громоздкими, если описывать химическое строение большой молекулы. Поэтому существует несколько вариантов сокращенных структурных формул. В формуле этилового спирта можно не указывать связи между водородом и углеродом: H3C-CH2OH, либо вообще исключить символы элементов и указать только связи углерод-углерод и функциональную группу: 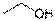 . Такие формулы, не теряя в своей информативности, занимают намного меньше места в записи.
. Такие формулы, не теряя в своей информативности, занимают намного меньше места в записи.
Теперь поговорим о химических уравнениях. Химические уравнения описывают химические реакции. Химическая реакция – это процесс[1], приводящий к разрушению одних химических связей и образованию других, в результате происходит превращение одного вещества в другое. Что важно, при этом не меняется количество атомов или их состав ядер. В химическую реакцию не вступают ядра атомов, то есть, не изменяется количество и тип нуклонов в ядре атома. Если такое происходит, то это не химическая, это ядерная реакция:
Дата добавления: 2018-04-05; просмотров: 465; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
