III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность. 6 страница
А·+·В®A:B
В левой части этого уравнения есть два атома А и В. У них имеется по одному электрону, что и отображено точками «·». При взаимодействии этих двух атомов, за счет их электронов, образуется общая электронная пара «:», и формируется химическая связь.
А сейчас ещё раз внимательно посмотрим на определение ковалентной связи атома: для её образования нужны два электрона и две атомных орбитали. Но в определении нет указания на то, общая пара электронов обязательно должна формироваться за счет электронов двух атомов. Ковалентная связь может возникнуть и в том случае, если один атом (донор) пожертвует имеющуюся у него пару электронов, а второй атом (акцептор, to accept(англ.) - принимать) её примет на свободную орбиталь (она – же вакантная орбиталь и лакуна). Это – донорно-акцепторный механизм образования ковалентной связи:
D: +  A®D:A
A®D:A
В этом уравнении D – донор с парой электронов (:), A – акцептор, имеющий лакуну (  ).
).
Обычно в качестве примера этих двух механизмов возникновения химической связи приводится процесс образования катиона аммония (NH4+). Эта частица образуется при взаимодействии катиона водорода (H+) и молекулы аммиака (NH3). Для начала опишем процесс образования молекулы аммиака. У атома азота имеется 3 неспареных электрона на валентном уровне, которые и будут использованы для образования общих пар с атомами водорода. Значит, валентность азота равна III.
|
|
|
7N 1s2  2s2
2s2  2p3
2p3 


У атома водорода на валентном уровне только один электрон. Его валентность равна I.
1H 1s1 
Следовательно, атом азота образует три связи с тремя атомами водорода по обменному механизму:
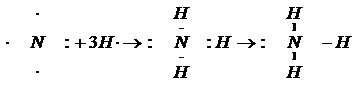 |
У атома азота в составе молекулы аммиака остается пара электронов. Именно на неё и претендует катион водорода(H+), у которого нет ни одного электрона:
1H+ 1s1 
И взаимодействие между катионом водорода и молекулой аммиака протекает по донорно-акцепторному механизму:
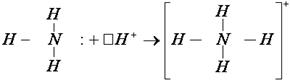
Что интересно, в этом катионе аммония положительный заряд равномерно распределен по всей частице, и это не смотря на то, что три связи с водородом образованы по обменному механизму, а четвертая по донорно-акцепторному.
Ковалентная связь обладает рядом характерных свойств:
• насыщаемостью;
• направленностью;
• полярностью и поляризуемостью
Под насыщаемостью подразумевается способность атома образовывать ограниченное количество связей, в соответствии с его валентностью. При этом на образование химической связи тратятся все неспаренные электроны, которые имеются у атома. Вернёмся к примеру молекулы аммиака:
У атома азота 3 неспареных электрона на валентном уровне 2p3:
7N 1s2  2s2
2s2  2p3
2p3 


У атома водорода на валентном уровне только один электрон 1s1:
|
|
|
1H 1s1 
Следовательно, атом азота образует три химические связи, а водород одну. Значит, в молекуле аммиака должно быть 3 атома водорода и 1 атом азота, формула аммиака NH3. Так вот, в соответствии со свойством насыщаемости, атом азота обязан использовать все свои неспаренные электроны. Поэтому соединений состава NH (азот отдал 1 электрон) или NH2 (азот отдал 2 электрона из 3х) не существует. Равно как и не существует соединений состава NH6 или NH7. Нет на валентном уровне у азота столько электронов, их всего – лишь 5. Количество образуемых по обменному механизму ковалентных связей определяется электронной конфигурацией атома - количеством неспаренных электронов, и при этом атомом используются все неспаренные электроны.
Однако, так как процесс образования химических связей атому энергетически выгоден, то атом может увеличить количество неспареных электронов за счет своих электронных пар с валентного уровня. Да, для этого процесса, называемого промотированием, придется потратить некое количество энергии, но энергетический эффект от образования большего количества химических связей эти затраты окупит. Такая своеобразная инвестиция. Обычно этот процесс рассматривается на примере атома углерода.
|
|
|
В невозбужденном состоянии атом углерода имеет только два неспаренных электрона:
6C 1s2  2s2
2s2  2p2
2p2 


Следовательно, должны существовать молекулы веществ, в которых валентность углерода равна II. И действительно, существует оксид углерода C=O. Его называют оксид углерода (II). Но в пределах 2го энергетического уровня можно провести промотирование. Один из электронов с 2s орбитали можно отправить на свободную p-орбиталь:
 |
6C 1s2  2s2
2s2  2p2
2p2 


В результате промотирования (показано стрелкой), атом углерода переходит в возбужденное состояние. Атомы, находящиеся в возбужденном состоянии помечают звездочкой, в данном примере С*.
6C* 1s2  2s1
2s1  2p3
2p3 


В возбужденном состоянии атом углерода имеет уже 4 неспаренных электрона, и его валентность равна IV. Поэтому кроме оксида углерода (II) с формулой CO, существует еще оксид углерода (IV) с формулой CO2. Химические связи в нем формируются вот так: O=C=O.
Но далеко не все атомы способны производить промотирование электрона. Промотироване возможно в том случае, если орбитали, участвующие в этом процессе, близки по энергии. Для иллюстрации этого примера возьмем два электронных аналога – кислород и серу. У этих атомов одинаковое количество неспаренных электронов на валентных уровнях:
|
|
|
8O 1s2  2s2
2s2  2p4
2p4 


16S 1s2  2s2
2s2  2p6
2p6 

 3s2
3s2  3p4
3p4 


Но у кислорода нет возможности промотирования электронов, а у серы есть. Над 2p подуровнем находится 3s подуровень. И эти подуровни принадлежат разным энергетическим уровням (разное главное квантовое число). Поэтому промотирование электрона с 2p подуровня на 3s подуровень энергетически невыгодно. Энергии придется затратить слишком много, и эти затраты не окупятся образованием новой химической связи. Получается, что валентность кислорода может быть равна только II.
8O 1s2  2s2
2s2  2p4
2p4 

 3s0
3s0 
Теперь посмотрим на электронную конфигурацию серы. Третий энергетический уровень не оканчивается на 3p-подуровне. На этом уровне существует еще 3d-подуровень с 5 свободными атомными орбиталями. И атом серы может промотировать на них либо один электрон с 3p-подуровня:
 |
16S 1s2  2s2
2s2  2p6
2p6 

 3s2
3s2  3p4
3p4 

 3d0
3d0 




И получить электронную конфигурацию с 4 неспаренными электронами, валентность атома серы в этом состоянии будет равна IV:
16S* 1s2  2s2
2s2  2p6
2p6 

 3s2
3s2  3p3
3p3 

 3d1
3d1 




Либо повторить эту процедуру еще раз и получить 6 неспаренных электронов, и, соответственно, валентность равную VI:
 |
16S* 1s2  2s2
2s2  2p6
2p6 

 3s2
3s2  3p3
3p3 

 3d1
3d1 




16S* 1s2  2s2
2s2  2p6
2p6 

 3s1
3s1  3p3
3p3 

 3d2
3d2 




Вот и получается, что у кислорода валентность может быть равна II, а у серы валентность переменная – может быть равна II, IV и VI.
Постоянную валентность проявляют только s-элементы (а их всего известно 12) и два элемента второго периода O, F. У остальных элементов валентность переменная. Очевидно, что проще описать конфигурацию валентного уровня, благо их не много, и они повторяются, чем заучивать переменные валентности для остальных элементов, ведь их еще где-то около 100.
Итак, суммарная валентность элемента равна сумме неспаренных электронов и числа связей, образованных по донорно-акцепторному механизму. В общем случае, максимально возможная валентность равна количеству электронов на валенном уровне, и его всегда можно подсмотреть в периодической таблице – это номер группы.
Согласно второму положению МВС перекрывание электронных облаков происходит по определенным направлениям в пространстве: раз электронные облака имеют определенную форму, то их максимальное перекрывание можно осуществить, только расположив их друг по отношению к другу определенным образом. Придать облакам определенную пространственную ориентацию. В этом и заключается свойство направленности ковалентной связи – максимальное перекрывание валентных электронных облаков взаимодействующих атомов возможно при определенной их взаимной ориентации. Следовательно, направление перекрывания электронных облаков будет определять форму молекулы. В зависимости от того, как ориентируются электронные облака при перекрывании, различают 3 вида химической связи. Их обозначают буквами греческого алфавита: σ (сигма), π(пи) и δ(дельта) связи.
Дата добавления: 2018-04-05; просмотров: 466; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
