III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность. 2 страница
Пользуясь этим стандартом намного проще выражать массы атомов и молекул. Масса атома, выраженная с помощью а.е.м. называется относительной атомной массой иобозначается Ar. Запись атомной массы выглядит так: само обозначение относительной атомной массы, затем в скобках указывается символ элемента. Таким образом, относительная масса атома кремния обозначается как Ar(Si). Значения Ar для всех атомов приведены в периодической таблице Менделеева. Обычно в расчетах значения Ar округляются до целых чисел, единственное исключение из этого правила – атом хлора. У него Ar принимается равной 35,5. Аналогично, с помощью а.е.м. выражается масса молекулы – относительная молекулярная масса, Mr. Записывается по тому – же принципу, что и Ar, сначала обозначение, в скобках формула молекулы. Для серной кислоты эта запись выглядит так: Mr(H2SO4). Так как молекулы состоят из атомов, то Mr высчитывается как сумма Ar всех атомов, входящих в состав молекулы:
Mr=∑Ar
Для молекулы серной кислоты, в состав которой входят 2 атома водорода, 1 атом серы и 4 атома кислорода Mr(H2SO4) = 2Ar(H)+Ar(S)+4(O). Ar(H) = 1, Ar(S)=32, Ar(O)=16. Несложно подсчитать, что относительная молекулярная масса серной кислоты равна 96. Ar и Mr являются безразмерными величинами. Они показывают во сколько раз масса атома или молекулы больше 1 а.е.м.
Итак, эталон массы для одной частицы есть. Нужен эталон на число частиц. С какими числами придется работать, если не будет удобного эталона? В 10 граммах воды содержится 3,34×1023 молекул. В привычном виде эта запись выглядит следующим образом:
|
|
|
334 000 000 000 000 000 000 000
Количество частиц (это могут быть не только молекулы, но и атомы, ионы) называется количество вещества. Количество вещества может обозначаться двумя буквами, либо n либо греческой «ню» ν. Для такого большого числа нужна соответствующая единица измерения – моль. Один моль это такое количество структурных единиц, которое содержится в 12 граммах изотопа углерода 12С. Один моль равен 6,02×1023 частиц – эта постоянная называется числом Авогадро и обозначается NA:
1 моль = 602 000 000 000 000 000 000 000
Один моль – это просто очень большое число. Будет уместно привести такой ряд: 1 болт, 10 болтов, 1000 болтов, 1 000 000 болтов, 1 000 000 000 болтов, 1 моль болтов, 10 моль болтов... Впрочем, что такое 1 моль тех самых 2,5-граммовых болтов?
1моль×2,5 грамма = 1 505 000 000 000 000 000 тонн = 1,5×1018 тонн
Масса Луны составляет 7,4×1019 тонн, так что масса одного моль 2,5 граммовых болтов все лишь в каких-то 50 раз меньше массы естественного спутника нашей планеты.
Эталон количества частиц – количество вещества, измеряемое в молях – есть. Эталон массы одной частицы – есть, осталось только связать их вместе. Умножив один моль на массу одной а.е.м. мы получим 1 грамм:
|
|
|
602 000 000 000 000 000 000 000 × 0, 000 000 000 000 000 000 16 г. = 1 г.
А раз так, то почему бы не определить массу одного моль какого-либо вещества в граммах, и просто умножать её на количество вещества, выраженное в молях. Собственно, это и есть молярная масса вещества. Обозначатся буквой M, единицы измерения грамм/моль. С её помощью можно определить количество вещества в некоторой его массе, или, наоборот вычислить массу вещества, которое потребуется для химической реакции:


Молярная масса численно равна относительной атомной массе, если речь идет об атомах, либо относительной молекулярной массе, если речь идет о молекулах:
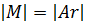

Здесь нужно сделать одно примечание. В физике и химии под одним молем частиц и, соответственно, молярной массой подразумеваются различные величины. Нам, химикам, в лабораториях расчеты вести удобнее в граммах, в то время, как физики приводят свои расчеты в килограммах. Соответственно, один моль в понимании физика – это величина 6,02×1026, в тысячу раз больше. И молярная масса в физике измеряется в килограммах на моль.
Следующий термин – эквивалент. Как показывает практика, это самое сложное из основных понятий химии для восприятия. Для начала определение: эквивалент – это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентна (равноценна) одному иону водорода в кислотно-основных или ионно-обменных реакциях или одному электрону в окислительно-восстановительных реакциях (ОВР). Несмотря на такое определение, использование эквивалента, во-первых, упрощает химические расчеты, а во-вторых, на нем базируется один из основных законов химии. Эквивалент – это просто некоторая часть молекулы. В качестве эквивалента можно взять всю молекулу целиком, её половинку (  ), треть молекулы (
), треть молекулы (  ), четверть (
), четверть (  ) и так далее. Разумеется, сама молекула так не делится в процессе химической реакции, это лишь проведенная человеком условная (виртуальная) граница между несколькими равноценными частями молекулы. Та доля молекулы, которая берется в качестве эквивалента, называется фактором эквивалентности. Обозначается буквой f и приводится в виде обычной дроби:
) и так далее. Разумеется, сама молекула так не делится в процессе химической реакции, это лишь проведенная человеком условная (виртуальная) граница между несколькими равноценными частями молекулы. Та доля молекулы, которая берется в качестве эквивалента, называется фактором эквивалентности. Обозначается буквой f и приводится в виде обычной дроби:
|
|
|
· Если f = 1, то в качестве эквивалента берется вся молекула;
· Если f =  , то в качестве эквивалента берется половина молекулы;
, то в качестве эквивалента берется половина молекулы;
· Если f = 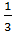 , то в качестве эквивалента берется треть молекулы и так далее.
, то в качестве эквивалента берется треть молекулы и так далее.
|
|
|
Как видно из определения эквивалента, то количество частей, на которое делится молекула, зависит от того, в какой химической реакции она участвует. В кислотно-основных реакциях количество частей определяется количеством ионов водорода, с которым взаимодействует молекула. Например, для реакции нейтрализации серной кислоты:
2NaOH + H2SO4 → 2H2O+Na2SO4
2OH- +2H+ → 2H2O.
Одна молекула серной кислоты (H2SO4) высвобождает в раствор два иона водорода (2H+), значит, одна молекула серной кислоты эквивалентна двум ионам водорода. Следовательно, в качестве эквивалента берется половина молекулы серной кислоты, а её фактор эквивалентности f(H2SO4) =  . На две молекулы щелочи (2NaOH) по уравнению реакции приходится два иона водорода (2H+). Значит, одна молекула щелочи эквивалентна одному иону водорода, и фактор эквивалентности щелочи f(NaOH) = 1. Две молекулы воды (2H2O) образуются при взаимодействии двух гидроксид-анионов и двух ионов водорода, значит, f(H2O) = 1. В реакции на одну молекулу сульфида натрия (Na2SO4) приходится два иона водорода, значит его фактор эквивалентности f(Na2SO4) =
. На две молекулы щелочи (2NaOH) по уравнению реакции приходится два иона водорода (2H+). Значит, одна молекула щелочи эквивалентна одному иону водорода, и фактор эквивалентности щелочи f(NaOH) = 1. Две молекулы воды (2H2O) образуются при взаимодействии двух гидроксид-анионов и двух ионов водорода, значит, f(H2O) = 1. В реакции на одну молекулу сульфида натрия (Na2SO4) приходится два иона водорода, значит его фактор эквивалентности f(Na2SO4) =  . Таким образом, можно определить фактор эквивалентности всех веществ, участвующих в реакции. Нужно просто определить, какое количество ионов водорода приходится на одну молекулу вещества.
. Таким образом, можно определить фактор эквивалентности всех веществ, участвующих в реакции. Нужно просто определить, какое количество ионов водорода приходится на одну молекулу вещества.
Теперь возьмем в качестве примера ортофосфорную кислоту:
NaOH + H3PO4 → H2O+NaH2PO4
В этой реакции ортофосфорная кислота отдает в раствор один ион водорода, значит, её эквивалентом является целая молекула, а f(H3PO4) = 1
2NaOH + H3PO4 → 2H2O+Na2HPO4
В этой реакции кислота теряет уже два атома водорода, поэтому её эквивалентом является половина молекулы, f(H3PO4) = 
3NaOH + H3PO4 → 3H2O+Na3PO4
В реакции полной нейтрализации кислота теряет все три атома водорода, поэтому её эквивалентом является треть молекулы, f(H3PO4) =  . Как видно из этих примеров, для одного вещества фактор эквивалентности может принимать различные значения. Это зависит от того, в какую именно реакцию вступает вещество.
. Как видно из этих примеров, для одного вещества фактор эквивалентности может принимать различные значения. Это зависит от того, в какую именно реакцию вступает вещество.
Аналогична ситуация и с окислительно-восстановительными реакциями, только здесь расчет ведется не по количеству ионов водорода, а по количеству электронов:
Zn + 2HCl → ZnCl2 + H2
Zn – 2e- →Zn2+
2H++2e-→H2
Цинк (Zn) теряет два электрона(2e-), его эквивалент – половина атома, f(Zn) =  . Два атома водорода, высвобожденные двумя молекулами соляной кислоты (HCl) приобретают два электрона, эквивалент соляной кислоты f(HCl) =1.
. Два атома водорода, высвобожденные двумя молекулами соляной кислоты (HCl) приобретают два электрона, эквивалент соляной кислоты f(HCl) =1.
Так как эквивалент – это часть молекулы, то с эквивалентом можно работать так же, как с любым другим веществом, участвующим в химической реакции: можно определить его количество вещества (да, зачастую это количество реально не существующих частиц) и его молярную массу. Для определения количества вещества эквивалента нужно поделить количество вещества на фактор эквивалентности. Так как эквивалент является частью от молекулы, то количество вещества эквивалента будет больше в то количество раз, на которое разбивается исходная молекула. Делим молекулу на три части – этих частей будет в три раза больше, чем исходных молекул:
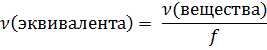
Количество вещества эквивалента измеряется в молях-эквивалентах. Полное обозначение количества вещества эквивалента выглядит так: ν(f(формула вещества)формула вещества), то есть, для серной кислоты из нашего примера ν(  (H2SO4)H2SO4), но такой громоздкой записью пользуются не всегда. Обычно к символу количества вещества добавляется нижний индекс «экв»: νэкв(H2SO4). Вычисление молярной массы эквивалента выполняется по аналогичному принципу. Раз исходная молекула делится на несколько частей, то очевидно, что масса одной части будет меньше массы исходной молекулы в то количество раз, на которое делится молекула. Так как относительная молекулярная масса численно равна молярной массе, то и для неё выполняется это соотношение:
(H2SO4)H2SO4), но такой громоздкой записью пользуются не всегда. Обычно к символу количества вещества добавляется нижний индекс «экв»: νэкв(H2SO4). Вычисление молярной массы эквивалента выполняется по аналогичному принципу. Раз исходная молекула делится на несколько частей, то очевидно, что масса одной части будет меньше массы исходной молекулы в то количество раз, на которое делится молекула. Так как относительная молекулярная масса численно равна молярной массе, то и для неё выполняется это соотношение:
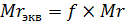
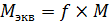
Для чего вообще нужно такое неочевидное понятие – эквивалент? Вещества вступают в химические реакции в определенном численном соотношении. Поэтому, для каждого вещества приходится рассчитывать свое количество вещества. Хорошо, если это соотношение невелико 1 к 3, 1 к 2, 1 к 1. Но не все химические реакции так просты. Вот в этих случаях и нужно понятие эквивалента. Для всех веществ, которые участвуют в химической реакции количество вещества эквивалента одинаково. Поэтому достаточно рассчитать количество вещества эквивалента для одного любого участника реакции, что – бы определить нужную массу исходных веществ, или массу получающихся продуктов. Собственно, постулат о том, что вещества реагируют в эквивалентных количествах, является одним из основных законов химии, с которыми пришла пора познакомиться.
Первый закон – закон сохранения масс, открыт Ломоносовым в 1756 году: масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции. Смысл закона предельно прост, вещество не может исчезнуть в «никуда» и появиться из «ниоткуда». Если в колбе находилось 300 грамм исходных веществ, то после проведения химической реакции суммарная масса продуктов составит все те – же 300 грамм.
Второй закон – закон постоянства состава: любое вещество независимо от способа его получения имеет постоянный качественный и количественный состав. К этому закону мы обращались, когда рассматривали термины «вещество» и «молекула». Вне зависимости от того, где, как и кем, получено какое-либо вещество, его молекулы имеют одинаковый состав и обладают одинаковыми свойствами. Хлорид натрия, полученный европейцами, африканцами, зелеными человечками из далекой галактики или эльфами с Валинора, все равно остается хлоридом натрия, вне зависимости от того, кто и как его получил. Этот закон ставит крест на популярной манипуляции об «искусственных» и «природных» веществах, нет никакой разницы, между веществом, полученным в лаборатории, и тем – же самым веществом, извлеченным из какого-либо природного источника. Например, запах сероводорода, выделенного из гейзера, и полученного в лаборатории одинаково отвратителен.
Третий закон – закон кратных отношений, открыт в 1803 году Дальтоном: если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа. Этот закон подтвердил существование неделимых в химических реакциях составных частей молекул, то есть, существование атомов. А раз атом не делится в химических реакциях, то в молекулу должно входить целое количество атомов. Это и есть современный смысл закона. В состав молекулы может входить только целое количество атомов. Не существует молекул, в которые входило – бы, например 2,5 атома кремния, 0,8 атома кислорода, 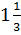 атома водорода.
атома водорода.
Четвертый закон – закон объемных отношений. Он же – закон Гей-Люссака: объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа.
Пятый закон – закон Авогадро, открыт в 1811 году: в равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул. У этого закона существует два следствия:
а) при определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем;
б) при н.у. (273,15 К и 101,325 кПа) молярный объем (Vм) любого газа равен 22,4 л/ моль.
Шестой закон выражается уравнением состояния идеального газа –уравнением Менделеева-Клапейрона:
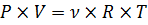
где Р – давление газа, Па; V – объем газа, м3; ν – количество вещества, моль; Т – абсолютная температура, К; R – универсальная газовая постоянная, равная 8,31 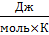 .
.
Седьмой закон – закон парциальных давлений, иногда упоминается как закон Дальтона: Давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь. Парциальное давление – это такое давление, которое один газ из смеси газов оказывал бы на стенки сосуда, если бы он в этом сосуде был единственным. Пусть имеется два одинаковых сосуда, которые находятся при одинаковой температуре. В каждом из этих сосудов есть некий газ, которой оказывает давление на стенки P1 и P2. Теперь возьмем такой же третий сосуд и перенесем туда газы из первого и второго сосуда. Давление в третьем сосуде будет равно сумме давлений первого и второго газов. P3=P2+P1, в данном случае P1 и P2 будут парциальными давлениями первого и второго газов соответственно.
Восьмой закон – закон эквивалентов: все вещества реагируют между собой в эквивалентных количествах:
νэкв1=νэкв2=νэкв3…
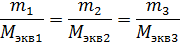
Так как количество вещества эквивалента можно выразить разными способами, то и закон эквивалентов может быть представлен разными формулировками и математическими выражениями:
Массы участвующих в реакции веществ пропорциональны их молярным массам эквивалента:

Такая формулировка удобна для решения задач на идентификацию вещества, так как по значению молярной массы эквивалента можно определить вещество. Альтернативный путь решения такой задачи подразумевает составление системы уравнений.
Для растворов количество вещества эквивалента можно выразить через их концентрации и объемы:

Эта форма закона эквивалентов является основой методов аналитической химии, которые предполагают использование химической реакции для установления количественного состава.
Вопросы для самоконтроля
1. Что такое атомная единица массы?
2. Что такое относительная атомная и относительная молекулярная масса? Как их найти, в каких единицах они выражаются?
3. Что такое количество вещества? Чему равен 1 моль?
4. Что такое молярная масса вещества? Как её вычислить? Как вычислить с её помощью нужную для реакции массу?
5. Что такое эквивалент? Как определяется фактор эквивалентности?
6. Как можно использовать эквивалент?
7. Перечислить основные законы химии. В чем заключается смысл закона кратных отношений? Как можно выразить закон эквивалентности?
Задания для самоконтроля
Пользуясь таблицей Менделеева вычислить относительные молярные массы следующих веществ:
а) Хлорид аммония (NH4Cl). Ответ: 53,5 гр/моль
б) Сульфат меди II (CuSO4), Ответ: 160 гр/моль
в) Оксид кремния IV (SiO2), Ответ: 60 гр/моль
Глава 2. Строение атома. Периодическая таблица Менделеева.
Согласно закону кратных отношений в составе молекул атом является неделимой частицей. Это не значит, что атом не делится вообще, ядерные реакции тому яркое (и смертоносное) подтверждение, но эти явления подробно рассматривает физика. Для химика важно знать, как структура атома определяет его химические свойства и как они взаимодействуют друг с другом. Как уже было сказано в предыдущей главе, атом состоит из двух частей – атомного ядра и электронной оболочки.
Дата добавления: 2018-04-05; просмотров: 438; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
