III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность. 12 страница
Закон действующих масс может быть адаптирован для описания реакций, протекающих в газовой фазе или на границе раздела фаз. Так как согласно уравнению состояния идеального газа при фиксированном объеме и температуре парциальное давление вещества определяется его количеством его частиц:
P= νRT/V
то для реакций в газовой фазе концентрации веществ могут быть заменены на их парциальные давления: 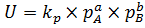 . Где p – парциальные давления газов A и B. Но в этом случае придется использовать другое значение константы скорости реакции (kp), адаптированной под парциальные давления. Если реакция протекает на границе раздела фаз, то концентрация вещества, находящегося в конденсированном состоянии (жидкость или твердое тело) вносится в константу. Например, для реакции:
. Где p – парциальные давления газов A и B. Но в этом случае придется использовать другое значение константы скорости реакции (kp), адаптированной под парциальные давления. Если реакция протекает на границе раздела фаз, то концентрация вещества, находящегося в конденсированном состоянии (жидкость или твердое тело) вносится в константу. Например, для реакции:
С(тв.) + О2(г) = СО2(г)
U = k·Cc·CО2 = k'·CО2, где k‘= k·Cc
Так как в результате вычисления по этому закону должна получится величина, измеряемая в  либо в
либо в 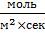 , то размерность константы скорости химической реакции зависит от вида закона и степеней, в которые взводятся концентрации. В общем случае константа скорости химической реакции имеет размерность
, то размерность константы скорости химической реакции зависит от вида закона и степеней, в которые взводятся концентрации. В общем случае константа скорости химической реакции имеет размерность 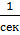 .
.
Однако, закон действующих масс имеет крайне ограниченную применимость. Дело в том, что уравнение химической реакции отражает сумму всех протекающих стадий. И для одной стадии, для одного акта элементарного взаимодействия этот закон работает. Но эти стадии между собой не равноценны. Например, в одной участвует одна молекула, в другой две, третья стадия протекает слишком быстро, без первой не запустится третья, а вторая течет параллельно с первой. Поэтому может оказаться, что скорость химической реакции не зависит от концентрации вещества B, хотя в химическом уравнении оно присутствует, а степень, в которую нужно возводить концентрацию вещества A дробная, и зависит от формы реактора. Впрочем, эти аспекты, и связанные с ними понятия молекулярности и порядка реакции подробно рассматриваются в курсе физической химии.
|
|
|
Зависимость скорости химической реакции от температуры описывается двумя уравнениями: правилом Вант-Гоффа и уравнением Аррениуса. Правило Вант-Гоффа является эмпирическим. То есть, оно получено опытным путем, без привлечения теории. Согласно правилу Вант-Гоффа скорость химической реакции увеличивается в 2-4 раза при повышении температуры на 100. Это выражается следующей формулой:
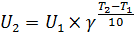
где U2 – скорость реакции при большей температуре T2, U1 – скорость реакции при меньшей температуре T1, γ – температурный коэффициент скорости реакции, он принимает значение от 2 до 4, и для каждой реакции значение γ свое. Так как это правило является наблюдением, полученным в определенных условиях, то оно имеет серьёзные недостатки:
|
|
|
1) Температурный коэффициент приходится подбирать для каждой реакции опытным путём.
2) Температурный коэффициент зависит от температуры, поэтому правило Вант-Гоффа применимо в ограниченном интервале температур (100-1000С).
Поэтому правилом Вант-Гоффа пользуются в том случае, если необходимо примерно оценить увеличение скорости изученной химической реакции при повышении температуры. В остальных случаях используется уравнение Аррениуса:
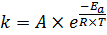
Где e – основание натурального логарифма 2,71, R – универсальная газовая постоянная, T – температура, K, А – предэкпоненциальный множитель, Ea – энергия активации. Проще всего физический смысл предэкпоненциального множителя и энергии активации объяснить в рамках теории активных соударений. Согласно этой теории, для запуска химической реакции необходимо выполнение двух условий:
1) Молекулы исходного вещества должны столкнуться с определенной энергией.
2) Это столкновение должен произойти под определенным углом.
Избыток энергии, которым должны обладать молекулы, относительно среднего уровня энергии при данной температуре, при котором их столкновение завершается химическим превращением и есть энергия активации (Ea, кДж/моль). То есть, энергия активации – это энергетический барьер, который должны преодолеть молекулы исходного вещества для превращения в продукты реакции. Чем меньше высота этого барьера, тем больше молекул могут преодолеть его в единицу времени, и тем быстрее идет реакция, поэтому в экспоненциальной функции стоит знак «-».
|
|
|
Что касается предэкпоненциального множителя, то он рассчитывается как произведение количества соударений в единицу времени в единице объема (z) на вероятность того, что молекулы столкнутся под нужным углом (вероятностный фактор, p):
A = p×z
По мере усложнения строения молекул вероятностный фактор начинает сильно влияет на ход химической реакции. Чем больше молекула – мишень, тем больше её мест может подвергнуться удару, и тем меньше вероятность того, что удар придется в нужный участок. В общем случае, химическую реакцию можно представить следующим образом:
1) Частицы исходных веществ сталкиваются под нужным углом и с нужной энергией.
2) В результате такого удара происходит формирование переходного состояния (активированного комплекса), в котором старые химические связи еще не полностью разрушились, а новые еще не до конца сформировались.
|
|
|
3) Перегруппировка активированного комплекса в продукты реакции.
Этот путь иллюстрируют энергетическими диаграммами химических реакций (рисунок 5.2). Имеется два исходных вещества A2 и B2. Вся совокупность этих молекул неким уровнем энергии Eисх.сост. Некоторые молекулы обладают большим уровнем энергии, поэтому их столкновение приводит к образованию активированного комплекса A2B2, его энергия – Eперех.сост. Затем активированный комплекс перегруппировывается в продукты реакции – молекулы AB, их уровень энергии – Eконеч.сост.
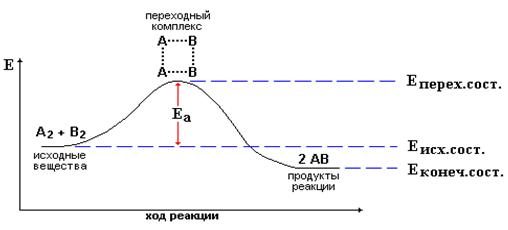
Рисунок 5.2. Энергетическая диаграмма реакции A2+B2→2AB
Разница между Eперех.сост и Eисх.сост является энергией активации, тем самым энергетическим барьером, который должны преодолеть молекулы. Разница между Eисх.сост и Eконеч.сост является энергетическим эффектом реакции. Если эта разница положительна, то реакция идет с выделением энергии, а если отрицательна – то с поглощением. Иногда слишком высокое значение энергии активации может сделать химическую реакцию невозможной, хотя по термодинамическим расчетам она должна быть самопроизвольной.
Так почему при повышении температуры растёт скорость реакции? Потому что чем выше температура – тем выше средний уровень энергии исходных частиц Eисх.сост. И чем он выше, тем меньше разница между Eперех-Eисх., меньше энергия активации. А меньший энергетический барьер единовременно преодолевает большее количество частиц.
Влияние катализатора тоже можно объяснить с помощью этой диаграммы. В классическом определении под катализатором понимается вещество, присутствие которого ускоряет реакцию, при этом катализатор не расходуется в процессе реакции и в состав продуктов не входит. Само явление ускорения химической реакции под воздействием катализатора называется катализом. А реакция, которая протекает в присутствии катализатора, называется каталитической. Однако, с тех пор были лучше изучены механизмы химических реакций, открыты новые явления, например межфазный катализ, поэтому в современной научной литературе под термином «катализ» может быть описано влияние формы реактора на ход химической реакции. Межфазный катализ заключается в том, что благодаря веществу-переносчику становится возможной гетерогенная реакция на границе органический растворитель – вода. То есть, в общем случае, под катализатором понимается какой – либо фактор, способствующий образованию активированного комплекса. Но вернемся к классическим катализаторам. С участием катализатора образуется новый активированный комплекс, то есть, катализатор запускает химическую реакцию по другому пути. И на этом альтернативном пути для образования активированного комплекса требуется меньшая энергия. То есть, энергия активации на каталитическом пути меньше (рисунок 5.3).

Рисунок 5.3. Энергетическая диаграмма влияния катализатора.
Более того, каталитический путь может быть длиннее обычного, например, активированных комплексов может быть не один, а несколько, но все равно, так как величина их энергий активации меньше, то реакция идет быстрее. Частицам исходного вещества проще преодолеть несколько меньших энергетических барьеров, чем один большой. Таким образом, правильно подобранный катализатор способен не только ускорить химическую реакцию, но и запустить невозможную при данных условиях реакцию из-за большой энергии активации.
Но и это еще не все. Так как катализатор запускает реакцию по другому пути, то подбирая катализатор, можно получать различные продукты химической реакции, что особенно важно в органической химии. Ведь чем сложнее молекула – тем больше появляется возможностей для второго реагента (либо вообще молекуле растворителя!) ударить по другому участку и образовать побочный продукт. Это свойство катализатора запускать одну реакцию (или группу реакций) из нескольких возможных называется селективностью. Наивысшей селективностью обладают ферменты – катализаторы сложной природы, которые ускоряют химические реакции в живых телах. И пока что в области катализа химических реакций возможности человека уступают природным. Да, большинство ферментов могут существовать только при температуре живого тела, зато из множества очень похожих веществ в организме некоторые ферменты работают только с одним! Биохимические реакции, объединенные в т.н. метаболические пути, в живых организмах осуществляется с помощью ферментов[35].
Но, увы, катализатор не является «волшебным средством» от всех проблем. Он никак не может повлиять на разность энергий исходных веществ и продуктов, следовательно, изменение энергии Гиббса реакции останется прежним. Поэтому химическую реакцию, которая термодинамически невозможна, катализатор запустить не может. Так – же катализатор не может повлиять на состояние равновесия, но об этом в следующем разделе.
И, разумеется, существует явление, обратное катализу, называемое ингибированием. Ингибирование – это явление замедления химической реакции в присутствии веществ – ингибиторов. Ингибиторы тоже запускают химическую реакцию по альтернативному пути, но у него энергия активации, наоборот, выше. Поэтому реакция идет медленнее. Или даже останавливаются. Это явление часто используется в медицине, когда нужно остановить какую – либо нежелательную химическую реакцию, можно ввести пострадавшему ингибитор.
Примеры решения задач по теме «Химическая кинетика»
Пример 1. В некотором реакторе протекает химическая реакция. При увеличении температуры на 300С её скорость возросла в 27 раз. Вычислить температурный коэффициент этой реакции для уравнения Вант-Гоффа.
Решение:
Согласно уравнению Вант-Гоффа скорость химической реакции при новой температуре (U2 при T2) можно вычислить как произведение скорости при исходной температуре (U1 при T1) и температурного коэффициента, возведенного в степень (T2-T1)/10:
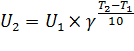
По условиям задачи нам известно соотношение U2/U1 = 27. Так же нам известна разность температур T2-T1 = 30. Отсюда уравнение Вант-Гоффа приобретает вид:
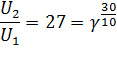
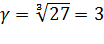
Ответ: температурный коэффициент реакции равен 3.
Пример 2. Имеется гомогенная реакция вида A+2B—3C+D. Константа скорости реакции = 0,5 1/сек. Концентрация вещества A = 0,5 моль/л, а вещества B = 0,3 моль/л. Вычислить скорость реакции.
Решение:
Согласно закону действующих масс скорость реакции равна произведению константы скорости реакции (k) на концентрации реагентов, взятых в степенях, соответствующих стехиометрическим коэффициентам уравнения реакции:
U=k×CA×CB2 = 0,5 1/сек ×0,5 моль/л × (0,3 моль/л)2 = 0,0225 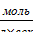
Ответ: скорость реакции 0,0225 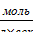 .
.
Вопросы для самоконтроля
1) Что такое химическая кинетика? Почему химической термодинамики не достаточно для описания химических реакций?
2) В каких единицах измеряется скорость химической реакции и почему?
3) От каких факторов зависит скорость химической реакции?
4) Что описывает закон действующих масс, и в каких случаях его можно использовать?
5) Что такое константа скорости химической реакции? От каких факторов она зависит?
6) Какими уравнениями описывается зависимость скорости химической реакции от температуры? Что такое температурный коэффициент реакции и энергия активации?
7) Что такое катализатор? В чем заключается его принцип действия?
8) Каких эффектов можно добиться, используя катализаторы и ингибиторы?
9) Почему невозможно провести термодинамически запрещенную реакцию с помощью катализатора?
Задания для самоконтроля.
1) Температурный коэффициент некоторой химической реакции равен 4. Во сколько раз возрастёт её скорость, если температуру увеличить на 500С? Ответ: в 1024 раза.
2) Рассчитать скорость реакцииAgNO3 + KCl → AgCl↓ + KNO3концентрации исходных веществ составляют соответственно 0,2 и 0,3 моль/л, а константа равна 1,5∙10-3л∙моль-1∙с-1
Ответ: U = 9·10-5 моль/л·с
3) При увеличении температуры с 30 до 45оС скорость гомогенной реакции повысилась в 20 раз. Чему равна энергия активации реакции?
Ответ: Ea = 160,25 кДж
5.3 Кинетика обратимых реакций. Химическое равновесие.
В главе 4 было упомянуто, что в химических уравнениях левая и правая части могут быть разделены знаком обратимости «D». Этот знак используется в том случае, если реакция является обратимой. Для понимания этого процесса нужно снова обратиться к рисунку 5.2.

Рисунок 5.2. Энергетическая диаграмма реакции A2+B2→2AB
Разница между энергией активированного комплекса и энергией исходных веществ является энергией активации – барьером, который должны преодолеть при столкновении молекулы исходного вещества. Так реализуется реакция, которая идет в прямом направлении – прямая реакция. А теперь посмотрим на вторую часть графика. Среди продуктов реакции есть молекулы, которые «не такие как все» (среди людей-то таких немало, нас всего – лишь 6,5 миллиардов, а счет частиц в химических реакциях идет на моли), которые обладают большей энергией. И этот запас энергии позволяет им проскочить энергетический барьер в обратном направлении. Поэтому, какая-то часть молекул продуктов вступает в реакцию, которая протекает в обратном направлении – обратную реакцию. Соответственно, разность между энергией активированного комплекса и энергией продуктов реакции является энергией активации обратной реакции.
Химические реакции, которые протекают и в прямом и в обратном направлении называются обратимыми. Так как среди гигантского количества частиц продукта химической реакции почти наверняка есть частицы с большим уровнем энергии, который позволяет запустить обратную реакцию, то, строго говоря, подавляющее большинство химических реакций является обратимыми. Остальные химические реакции, которые протекают только в прямом направлении, называются необратимыми. Необратимой реакция может быть, потому что один из её продуктов удаляется из реактора, например, является газом, или выпадает в осадок, и, таким образом, лишается возможности столкнуться с другими продуктами реакции. Или – же энергия активации обратной реакции может иметь слишком большое значение. В уравнении необратимых химических реакций ставится знак необратимости «→»:
CuCl2+2NaOH→Cu(OH)2↓+2NaCl
Итак, по мере протекания химической реакции происходит уменьшение концентраций исходных веществ и рост продуктов. Если реакция обратима – то в ней протекает и прямая, и обратная реакция. А из этого факта следует, что скорость прямой реакции будет уменьшаться, а обратной наоборот увеличиваться. Для реакции вида aA+bBDcC+dD закон действующих масс примет вид:
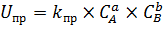 – скорость прямой реакции, так как CA и CB уменьшаются, то и Uпр будет падать.
– скорость прямой реакции, так как CA и CB уменьшаются, то и Uпр будет падать.
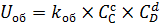 – скорость обратной реакции, так как CC и CD растут, то и Uоб будет расти.
– скорость обратной реакции, так как CC и CD растут, то и Uоб будет расти.
Следовательно, со временем, скорость прямой реакции сравняется со скоростью обратной реакции:
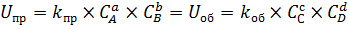
То есть, исходные вещества будут тратиться на прямую реакцию в таком – же количестве, в котором они образуются в результате обратной реакции. Аналогична ситуация и для продуктов C и D. Это состояние, в котором скорость прямой реакции равна скорости обратной, а концентрации всех участников не меняются, называется состоянием химического равновесия. Концентрации веществ, которые устанавливаются при состоянии равновесия, называются равновесными. Они обозначаются квадратными скобками, в нашем примере равновесная концентрация вещества A обозначается как [A]. Поскольку скорость прямой реакции равна скорости обратной, то состояние равновесия можно охарактеризовать отношением констант прямой и обратной реакции:
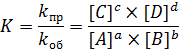
Отношение констант прямой и обратной реакции называется константой химического равновесия (K). Она показывает, во сколько раз константа скорости прямой реакции больше константы скорости обратной реакции, если равновесные концентрации равны 1 моль/л. Само математическое выражение является законом действующих масс для состояния равновесия: отношение произведения молярных концентраций продуктов реакции к произведению молярных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов, при данной температуре равно постоянной величине, называемой константой химического равновесия. При расчете по закону действующих масс для химического равновесия концентрации конденсированных фаз (жидкости и твердые тела) принимаются равными 1. Несложно увидеть, что на величину константы равновесия влияют те – же факторы, что и на константы химических реакций: температура, природа веществ, давление и так далее. Аналогично константам скоростей константа равновесия не зависит от равновесных концентраций, наоборот, равновесные концентрации определяются константой равновесия.А так – же на константу равновесия не может повлиять катализатор. Снижая величину энергетического барьера, катализатор снижает энергии активации прямой и обратной реакции на одинаковую величину. Поэтому ввод катализатора вызовет одинаковое увеличение констант и прямой и обратной реакции, но их соотношение – константа равновесия, останется прежней. Поэтому в равновесные реакции катализатор вводится не с целью изменения равновесных концентраций, а для ускорения достижения состояния равновесия.
Дата добавления: 2018-04-05; просмотров: 258; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
