Билет 25 Аморфные тела и стекла:особенности строения и свойства
Аморфные тела- конденсированное состояние веществ, атомная структура которых имеет ближний порядок и не имеет дальнего порядка, характерного для кристаллических структур.
Аморфные тела- это стекло, смола, канифоль, многие пластмассы, сургуч, пластическая сера, янтарь, различные полимеры — органические аморфные тела (целлюлоза, каучук, кожа, плексиглас, полиэтилен) и др.
Основные свойства аморфных тел
1)У аморфных тел нет кристаллической решетки, у них обнаружен только ближний порядок в расположении молекул.
2)Аморфное тело обладает слабо выраженной текучестью.
3)У аморфных тел нет определенной температуры плавления.
4)Аморфные тела изотропны, т.е. их физические свойства по всем направлениям одинаковы.
5)Внутренняя энергия вещества в аморфном состоянии больше, чем в кристаллическом.
Билет 26 Скорость химической реакции
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Например, для реакции: 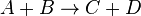 выражение для скорости выглядит:
выражение для скорости выглядит:  .
.
скорость химической реакции — величина всегда положительная
Зависимость Влияния на с.х.р
Температурой
В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:

Природой Реагирующих веществ
|
|
|
Константа скорости реакции зависит в первую очередь от природы реагирующих веществ. Калий быстрее взаимодействует с водой, чем натрий, а литий - еще медленнее натрия. Водород реагирует с кислородом очень быстро (часто со взрывом), а азот с кислородом - крайне медленно и лишь в жестких условиях (электрический разряд, высокие температуры).
Концентрацией
При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением.
Билет 27.Химический катализ
Хим.катализ- химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами).
Энергия активации процессов, катализируемых твердыми растворами, изменяется с составом сплавов непрерывно, а в случае реакций, катализируемых гетерогенными сплавами, изменяется по линейному закону.
Гомогенный катализ
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO
H2О2 + IO → H2О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
|
|
|
Гетерогенный катализ
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности
Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
1. Диффузия реагирующих веществ к поверхности твердого вещества
2. Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
3. Химическая реакция между реагирующими молекулами
4. Десорбция продуктов с поверхности катализатора
5. Диффузия продукта с поверхности катализатора в общий поток
Дата добавления: 2018-04-04; просмотров: 602; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
