Билет 31. Химические свойства воды: термическое разложение, взаимодействие с оксидами, взаимодействия с солями, взаимодействие с металлами
Под воздействием очень высоких температур вода разлагается на молекулярный кислород и молекулярный водород:: 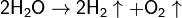
1) Вода реагирует со многими металлами с выделением водорода:
2Na + 2H2O = H2 + 2NaOH(бурно)
2K + 2H2O = H2 + 2KOH(бурно)
3Fe + 4H2O = 4H2 + Fe3O4(только при нагревании)
*Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.. (Смотреть электрохимический ряд металлов!)
Вода реагирует со многими оксидами неметаллов:
| SO2 | + | H2O | = | H2SO3 |
| CO2 | + | H2O | = | H2CO3 |
Некоторые оксиды металлов также могут вступать в реакции соединения с водой:
| CaO | + | H2O | = | Ca(OH)2 |
*Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует.
Вода реагирует при комнатной температуре с солями, образуя гидриды:
KCl +H2O = KOH + HCl
Билет 32. Электролитическая диссоциация Теория Аррениуса
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Вещества, водные растворы или расплавы которых проводят электрический ток, называются электролитами.
К ним относятся вода, кислоты, основания и соли. При растворении в воде молекулы электролитов диссоциируют на положительные ионы – катионы и отрицательные – анионы. Процесс электролитической диссоциации обусловлен взаимодействием веществ с водой или другим растворителем, что приводит к образованию гидратированных ионов.
|
|
|
Теория электролитической диссоциации С. Аррениуса содержит следующие положения:
Теория электролитической диссоциации С. Аррениуса содержит следующие положения:
1) при растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации);
2) под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+);
3) электролитическая диссоциация – процесс обратимый (обратная реакция называется моляризацией);
4) степень электролитической диссоциации α (Приложение Г) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n), к общему числу молекул, введенных в раствор (N): 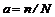
*Однако теория С. Аррениуса не учитывала всей сложности явлений в растворах. В частности, она рассматривала ионы как свободные, независимые от молекул растворителя частицы. Теории С. Аррениуса противостояла химическая, или гидратная, теория растворов Д.И. Менделеева, в основе которой лежало представление о взаимодействии растворенного вещества с растворителем. Кажущееся противоречие обеих теорий было устранено предположением о гидратации ионов (И.А. Каблуков).
|
|
|
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Степень диссоциации равна отношению продиссоциированных молекул вещества n к общему числу его молекул N. Выражается в долях или процентах. 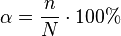
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как, например, когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы. Константа диссоциации обычно обозначается Kd.
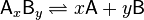
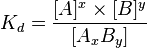
Различают сильные и слабые электролиты. Сильные электролиты в растворах практически диссоциированы полностью. Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как HCl, HBr, HI, HNO3, H2SO4 ). Растворы сильных электролитов при больших концентрациях обладают значительной электропроводностью, причем она с разбавлением растворов возрастает незначительно.
|
|
|
Слабые электролиты в водных растворах лишь частично (обратимо) диссоциируют на ионы. Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты, такие как HF), основания p-, d- и f-элементов
.Растворы слабых электролитов при больших концентрациях отличаются незначительной электропроводностью, сильно увеличивающейся при разбавлении растворов.
Дата добавления: 2018-04-04; просмотров: 663; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
