Билет 16.Второй закон термодинамики. Энтропия
Второй закон связан с понятием энтропии, являющейся мерой хаоса (или мерой порядка). Второй закон термодинамики гласит, что для вселенной в целом энтропия возрастает.
Существует два классических определения второго закона термодинамики :
- Кельвина и Планка
Не существует циклического процесса, который извлекает количество теплоты из резервуара при определенной температуре и полностью превращает эту теплоту в работу. (Невозможно построить периодически действующую машину, которая не производит ничего другого, кроме поднятия груза и охлаждения резервуара теплоты)
- Клаузиуса
Не существует процесса, единственным результатом которого является передача количества теплоты от менее нагретого тела к более нагретому. (Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара)
Оба определения второго закона термодинамики опираются на первый закон термодинамики, утверждающий, что энергия убывает.
Второй закон связан с понятием энтропии (S).
Энтропия порождается всеми процессами, она связана с потерей системы способности совершать работу. Рост энтропии - стихийный процесс. Если объем и энергия системы постоянны, то любое измение в системе увеличивает энтропию. Если же объем или энергия системы меняются, энтропия системы уменьшается. Однако, энтропия вселенной при этом не уменьшается.
|
|
|
Для того, чтобы энергию можно было использовать, в системе должны быть области с высоким и низким уровнями энергии. Полезная работа производится в результате передачи энергии от области с высоким уровнем энергии к области с низким уровнем энергии.
- 100% энергии не может быть преобразовано в работу
- Энтропия может вырабатываться, но не может быть уничтожена
Билет 17.Термодинамический потенциал Гиббса
Это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:

где  — внутренняя энергия,
— внутренняя энергия,  — давление,
— давление,  — объём,
— объём,  — абсолютная температура,
— абсолютная температура, 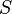 — энтропия.
— энтропия.
В химических процессах одновременно действуют два противоположных фактора — энтропийный (  ) и энтальпийный (
) и энтальпийный (  ). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (
). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (  ):
):

При  процесс может протекать, при
процесс может протекать, при  процесс протекать не может
процесс протекать не может
Если же  , то система находится в состоянии химического равновесия.
, то система находится в состоянии химического равновесия.
Билет 18. Агрега́тное состоя́ние вещества
|
|
|
Обладает свойствами
· способностью (твёрдое тело) или неспособностью (жидкость, газ, плазма) сохранять объём и форму,
· наличием или отсутствием дальнего (твёрдое тело) и ближнего порядка (жидкость), и другими свойствами.
Традиционно выделяют три агрегатных состояния: твёрдое тело, жидкость и газ.
Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других физических величин
 -Диаграмма однокомпонентной системы
-Диаграмма однокомпонентной системы
Дата добавления: 2018-04-04; просмотров: 1150; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
