Билет 19. Природа и виды межмолекулярных взаимодействий.Водородная связь
Межмолекулярное взаимодействие - взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей. В их основе, как и в основе химической связи, лежат электрические взаимодействия.
Силы Ван-дер-Ваальса включают все виды межмолекулярного притяжения и отталкивания.
Ориентационное взаимодействие
Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают
Индукционное взаимодействие
Если рядом с полярная молекула окажется полярная рядом с неполярными, она начнет влиять на них.
Дисперсионное взаимодействие
Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться окажется сосредоточенными с одной стороны молекулы, то есть неполярная частица станет полярной.
Межмолекулярное отталкивание
Если бы молекулы только притягивались друг к другу, это привело бы к их слиянию
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.
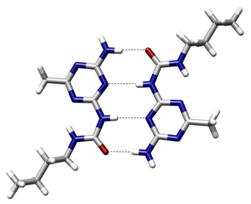
Особенности водородной связи.Отличительная черта водородной связи – сравнительно низкая прочность, ее энергия в 5–10 раз ниже, чем энергия химической связи. По энергии она занимает промежуточное положение между химическими связями и Ван-дер-ваальсовыми взаимодействиями, теми, что удерживают молекулы в твердой или жидкой фазе.
|
|
|
Билет 20 : Растворы Тепловой эффект растворения.Растворы реальные и идеальные.
Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. «Гомогенный» — значит, каждый из компонентов распределен в массе другого в виде своих частиц, то есть атомов, молекул или ионов.
Стандартная энтальпия растворения — ΔHраств, тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. Складывается из теплоты разрушения кристаллической решетки и теплоты гидратации (или теплоты сольватации для неводных растворов), выделяющейся в результате взаимодействия молекул растворителя с молекулами или ионами растворяемого вещества с образованием соединений переменного состава — гидратов (сольватов).
Под энтальпией гидратации — ΔHгидр, понимается теплота, которая выделяется при переходе 1 моля ионов из вакуума в раствор.
Идеа́льными раство́рами называют растворы, в которых предполагается отсутствие взаимодействий между частицами составляющих веществ, а химический потенциал каждого компонента имеет простую зависимость от концентрации. Для идеальных растворов выполняются законы Рауля и Генри. Идеальные растворы делятся на бесконечно-разбавленные и совершенные.
Свойства реальных растворов значительно отличаются от свойств идеальных растворов, когда молекулы растворенного газа подвергаются различным превращениям (химическая реакция, диссоциация, ассоциация и т. д.).
|
|
|
Билет 21: Коллигативные свойства растворов:закон Ванг-Гофф.закон Рауля
Коллигативные свойства растворов — это свойства растворов, обусловленные только самопроизвольным движением молекул, то есть они определяются не химическим составом, а числом кинетических единиц — молекул в единице объёма или массы. К таким коллигативным свойствам относятся:
Понижение давления насыщенного пара,Повышение температуры кипения растворов,Понижение температуры замерзания растворов,Возникновение осмотического давления.
Первый закон Рауля:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
|
|
|
p = p0 · χр-ль, где
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем;
χр-ль —— мольная доля растворителя.
Для растворов электролитов используют несколько другую форму уравнения, позволяющую добавить в неё изотонический коэффициент:
Δp = i · p0 · χв-ва, где
Δp — собственно изменение давления по сравнению с чистым растворителем;
χв-ва — мольная доля вещества в растворе.
Второй закон Рауля:
Повышение температуры кипения раствора по сравнению с температурой кипения растворителя, а равно и понижение температуры замерзания раствора по сравнению с аналогичным характеризующей величиной для растворителя прямо пропорциональна моляльности раствора, то есть,
ΔTкип/зам= Kэб/кр · mв-ва, где
Kэб/кр — соответственно эбулиоскопическая (от лат. ebullire — «кипеть» и др.-греч. σκοπέω — «наблюдаю») и криоскопическая (относится к замерзанию) константы, характерные для данного растворителя;
mв-ва — моляльность вещества в растворе.
Правило Вант-Гоффа:
V2=V1*γ^(T2-T1/10)
где V2 — скорость реакции при температуре T2, V1 — скорость реакции при температуре T1, γ— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
|
|
|
.
Билет 22:Растворимость.Зависимость растворимости от агрегатного состояния веществ и температуры.Закон Генри
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Все вещества в той или иной степени растворимы в растворителях. В случае, когда растворимость слишком мала для измерения, говорят, что вещество нерастворимо.
Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Растворимость зависит от растворяемого вещества, растворителя, температуры, давления, наличия в растворителе других веществ.
Растворимость большинства газов растет с ростом давления и уменьшается с ростом температуры. Для твердых и жидких веществ влияние давления на растворимость менее значимо, чем для газов.
Зако́н Ге́нри — закон, по которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений.
Закон описан английским химиком У. Генри в 1803 г.
C = kp ,
где:
p, — парциальное давление газа над раствором, Па
c, — молярная концентрация газа в растворе, моль/л
k, — коэффициент (константа) Генри, моль/(Па*л). Коэффициент зависит от природы газа и растворителя, а также от температуры.
Билет№23:
Концентрация — величина, характеризующая количественный состав раствора.
Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора), правильно называть «долями».
Классификация растворов по концентрации
В зависимости от цели для описания концентрации растворов используются разные физические величины.
Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить ещё некоторое его количество.
Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется.
Пересыщенный раствор — раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе, избыток вещества легко выпадает в осадок.
Концентрированный раствор — раствор с высоким содержанием растворённого вещества в противоположность разбавленному раствору, содержащему малое количество растворённого вещества.
Разбавленный раствор — раствор с низким содержанием растворённого вещества.
Выражение концентрации растворов
Массовая доля
ω =m1/m2
Объемная доля
φ =V1/V
Молярная доля
Xi=ν i/vобщ
Молярность
Cm=ν /V
ν -моль
Нормальность
Сн=Сn=z*ν /V
Моляльность
m=ν /m2
Билет 24 Кристаллическое состояние вещества
Кристаллическое состояние вещества
Упаковка кристалла способ взаимного расположения атомов, ионов или молекул в кристалле. . Наиболее эффективным типом упаковки таких сфер является гексагональная или кубическая плотная упаковка.
Элементарная ячейка кристаллической решетки - это минимальный по объему параллелепипед, перемещением которого вдоль его ребер можно воспроизвести всю кристаллическую решетку.
Одна из главнейших особенностей кристаллических структур — закономерная повторяемость в пространстве их узлов, рядов и плоских сеток. Отсюда характерные свойства кристаллических веществ: а) однородность строения (однородностью кристалла назовём одинаковость узора взаимного расположения атомов во всех частях его объема); б) анизотропия (в изотропных телах все свойства—теплопроводность, электропроводность, твёрдость царапания и т.д.
Дефекты кристаллической решетки
Разлчиают несколько дефектов:
Поверхностные
Линейные
Точеченые
Дата добавления: 2018-04-04; просмотров: 1119; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
