Билет 33 Закон разбавления Оствальда
Закон разбавления Оствальда - соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
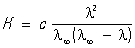
Здесь К — константа диссоциации электролита, с — концентрация, l и l¥ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием действующих масс закона и равенства l/l¥ = a, где a — степень диссоциации. Оствальда закон разбавления выведен В. Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности Оствальда закона разбавления имело большое значение для обоснования теории электролитической диссоциации.
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода и анионы кислотного остатка.
Основность кислоты определяется по числу атомов водорода.
Н3РО4  Н+ + Н2РО-4(первая ступень)
Н+ + Н2РО-4(первая ступень)
Н2РО-4  Н+ + НРO2-4 (вторая ступень)
Н+ + НРO2-4 (вторая ступень)
НРО2-4  Н+ PОЗ-4 (третья ступень)
Н+ PОЗ-4 (третья ступень)
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей.Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО2-4, НРО2-4 и РО3-4.
|
|
|
Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп). Например, NН4ОН - однокислотное основание, Са(ОН)2 - двухкислотное, Fе(ОН)3 - трехкислотное и т.д. Двух- и многокислотные основания диссоциируют ступенчато.
Ca(ОН)2  Са(ОН)+ + OH- (первая ступень)
Са(ОН)+ + OH- (первая ступень)
Ca(OH)+  Ca2++OH- (вторая ступень)
Ca2++OH- (вторая ступень)
Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы Н+ и ОН- (в незначительных количествах):
Н2O  Н+ + ОН-
Н+ + ОН-
Соли - ϶ᴛᴏ электролиты, которые диссоциируют в растворе на катионы металлов (и NH4+) и анионы кислотных остатков.
1. Нормальные, двойные, смешанные и комплексные соли диссоциируют по типу сильного электролита (необратимо) только в одну ступень.
2. Кислые, основные соли диссоциируют ступенчато, но по первой ступени необратимо (по типу сильного электролита), а далее – обратимо, как слабые электролиты.
Дата добавления: 2018-04-04; просмотров: 810; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
