Билет 34 Взаимодействие ионов в растворах

С увеличением ионной силы раствора коэффициент активности уменьшается. Однако, достигнув определенного минимального значения, коэффициент активности при дальнейшем увеличении ионной силы возрастает.
Зависимость коэффициента активности иона от ионной силы очень разбавленного водного раствора электролита выражается следующей формулой Дебая и Хюккеля: 
Коэффициент активности, g, – коэффициент, учитывающий все виды взаимодействий в растворах, приводящие к отклонению от свойств идеального раствора.
Определить активности каждого иона в отдельности невозможно, поэтому для одно-однозарядных электролитов пользуются средними геометрическими значениями активностей:
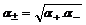 ,
,
и коэффициентов активностей:
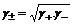 . (2.54)
. (2.54)
Коэффициент активности увеличивается с повышением температуры в результате возмущающего действия кинетической энергии частиц в растворе на его «строение».
Уменьшение концентрации увеличивает коэффициент активности в результате увеличения расстояний между ионами и уменьшения электростатического взаимодействия.
* Законы Рауля и принцип Вант-Гоффа не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток – растворов электролитов. Обобщая экспериментальные данные, Вант-Гофф пришел к выводу, что растворы электролитов всегда ведут себя так, будто они содержат больше частиц растворенного вещества, чем следует из аналитической концентрации: повышение температуры кипения, понижение температуры замерзания, осмотическое давление для них всегда больше, чем вычисленные. Для учета этих отклонений Вант-Гофф внес в уравнение (2.22) для растворов электролитов поправку – изотонический коэффициент.
|
|
|
Изотонический коэффициент i – коэффициент, характеризующий отклонение от законов идеальных растворов вследствие электролитической диссоциации.
По определению изотонический коэффициент − это отношение всех частиц к числу растворенных:
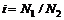 , (2.36)
, (2.36)
где N1 − число всех частиц, находящихся в растворе;
N2 − число растворенных молекул
Билет 36 Показатель кислотности Ph шкала кислотности.буферные растворы
Кислотность водного раствора обусловлена наличием в нем положительных водородных ионов Н+ и оценивается концентрацией в 1 литре раствора C(H+) (моль/л или г/л).В кислых растворах преобладают ионы Н+, в щелочных – ионы ОН–, однако их произведение в любых условиях постоянно.На практике степень кислотности (или щелочности) раствора выражается водородным показателем рН, представляющим собой отрицательный десятичный логарифм молярной концентрации водородных ионов рН = –lgC(H+). Эта величина может изменяться в небольших пределах – чаще – от 0 до 14. Кислыми называют растворы, в которых рН < 7, и, соответственно, чем ниже уровень pH, тем кислее раствор. В щелочных растворах рН > 7, и, чем ближе это значение к 14, тем раствор считается более щелочным. Нейтральная среда имеет показатель ph, равный 7 (при комнатной температуре).Показатель рН непосредственно влияет на нормальное протекание всех биохимических процессов у живых организмов. Очень важно, чтобы все процессы проходили при строго заданной кислотности. В частности, это необходимо для нормального функционирования биологических катализаторов – ферментов (при выходе за эти пределы их активность может резко снижаться). В клетках организма рН имеет значение около 7, во внеклеточной жидкости – 7,4. Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания. Различают буферные растворы двух типов:
|
|
|
1)Кислотные т.е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например - ацетатный буфер
|
|
|
2)Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например – аммиачный буфер.
Дата добавления: 2018-04-04; просмотров: 627; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
