Билет 37 Гидролиз солей.количественные характеристики реакции солей
Гидролиз солей - это реакция обмена ионов соли с водой, в результате которой изменяется кислотность раствора. Гидролиз – процесс обратный реакции нейтрализации. Если реакция нейтрализации процесс экзотермический и необратимый, то гидролиз – процесс эндотермический и обратимый.
Тип гидролиза соли зависит от природы основания и кислоты, образующих соль. Возможны 3 типа гидролиза солей. Гидролиз по аниону идет, если соль образована катионом сильного основания и анионом слабой кислоты. Например, соль СН3СООNa образована сильным основанием NaOH и слабой одноосновной кислотой СН3СООН. Гидролизу подвергается ион слабого электролита СН3СОО–.
СН3СОО– + НОН « СН3СООН + ОН–
Ионы Н+ воды связываются с анионами СН3СОО– в слабый электролит СН3СООН, ионы ОН– накапливаются в растворе, создавая щелочную среду (рН>7). Молекулярное уравнение гидролиза соли: CH3COONa + H2O « CH3COOH + NaOH Гидролиз солей многоосновных кислот протекает по стадиям, образуя в качестве промежуточных продуктов кислые соли.Реакция среды щелочная (pH>7), т.к. в растворе накапливаются ОН–-ионы. Гидролиз соли идет тем сильнее, чем меньше константа диссоциации образующейся при гидролизе слабой кислоты (табл.3). Таким образом, водные растворы солей, образованных сильным основанием и слабой кислотой, характеризуются щелочной реакцией среды. Гидролиз по катиону идет, если соль образована катионом слабого основания и анионом сильной кислоты. Ионы водорода Н+ накапливаются в растворе, создавая кислую среду (рН<7). Чем меньше константа диссоциации образующегося при гидролизе основания, тем сильнее идет гидролиз.Таким образом, водные растворы солей, образованных слабым основанием и сильной кислотой, характеризуются кислой реакцией среды.
|
|
|
Гидролиз по катиону и аниону идет, если соль образована катионом слабого основания и анионом слабой кислоты. Соли, образованные катионами сильных оснований и анионами сильных кислот, гидролизу не подвергаются, так как ни один из ионов соли не образует с ионами Н+ и ОН– воды слабых электролитов. Водные растворы таких солей имеют нейтральную среду.
Количественно гидролиз солей может быть охарактеризован степенью гидролиза и константой гидролиза.h - степень гидролиза показывает, какая часть соли прогидролизовалась, то - есть превратилась в свои составляющие. Измеряется в процентах или долях единицы. Степень гидролиза не является константой.Изменяется с температурой, зависит от константы соляного раствора.
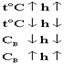 KГ - константа гидролиза - константа равновесия обратимой реакции. Зависит от температуры, но не зависит от концентрации раствора.
KГ - константа гидролиза - константа равновесия обратимой реакции. Зависит от температуры, но не зависит от концентрации раствора.
|
|
|
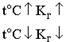 Рассмотрим соль гипохлорит натрия, образованную сильным основанием и слабой кислотой:
Рассмотрим соль гипохлорит натрия, образованную сильным основанием и слабой кислотой:
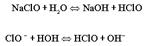 Константа равновесия данной обратимой реакции равна:
Константа равновесия данной обратимой реакции равна:
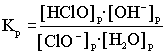 .Поскольку вода - очень слабый электролит, её равновесную концентрацию можно считать константой: В результате перемножения двух констант получается новая константа -константа гидролиза соли.
.Поскольку вода - очень слабый электролит, её равновесную концентрацию можно считать константой: В результате перемножения двух констант получается новая константа -константа гидролиза соли.
Дата добавления: 2018-04-04; просмотров: 549; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
