Завдання 16-30 мають кілька правильних відповідей. Оберіть правильні, на Вашу думку, відповіді
16. До електролітів відносяться:
а) солі; б) оксиди; в) кислоти; г) основи.
17. Вкажіть речовини, які у водних розчинах є електролітами:
а) спирт; в) нітратна кислота;
б) глюкоза; г) амоній хлорид.
18. Вкажіть речовини, які у водному розчині дисоціюють з утворенням йона Fe2+:
а) FeCl2; б) FeSO4; в) Fe(OH)2; г) FeCO3.
19. До слабких електролітів відносяться:
а) Na2CO3; б) H2CO3; в) K2CO3; г) HNO2.
20. Ліва частина скороченого йонного рівняння ОН-+Н+= відповідає взаємодії у розчині:
а) магній гідроксиду та хлоридної кислоти;
б) сульфатної кислоти та калій гідроксиду;
в) натрій карбонату та калій гідроксиду;
г) натрій гідроксиду та нітратної кислоти.
21. Назвіть формули електролітів, дисоціація яких відбувається за одну стадію:
а) HCl; б) H2SO4; в) CH3COOH; г) Ba(OH)2.
22. Однакова кількість позитивно і негативно заряджених йонів утвориться при повній дисоціації 1 моль:
а) Na2SO4; б) AlCl3; в) HCOOK; г) CH3COOH.
23. До сильних електролітів належать:
а) FeCl3; б) H2SO3; в) H2SO4; г) HNO2.
24. Необоротна реакція відбувається між такими парами речовин:
а) KCl+AgNO3→; в) NH4OH+HCl→;
б) Na2CO3+HCl→; г) Na2S+HNO3→.
25. Реакції йонного обміну у розчинах електролітів відбуваються до кінця, якщо:
а) утворюється осад; б) виділяється газ;
|
|
|
в) утворюється слабкий електроліт; г) утворюється сильний електроліт.
26. Реакція Са3(РО4)2+3H2SO4=3CaSO4+2H3PO4 відбудеться до кінця, тому що:
а) виділяється газ; б) утворюється осад; в) інша причина;
г) реагуюча кислота сильніша від тієї, якою утворена сіль.
27. Додавання нітрату амонію до водного розчину аміаку
а) викликає зменшення ступеня дисоціації основи;
б) призводить до збільшення ступеня дисоціації основи;
в) не впливає на дисоціацію основи;
г) викликає збільшення концентрації гідроксид- йонів.
28. До електролітів середньої сили відносяться:
а) HNO2; б) H2SO3; в) H3PO4; г) NH4OH.
29. При зливанні розчинів яких речовин реакція йде до кінця:
а) барій хлориду та кальцій нітрату;
б) барій гідрогенкарбонату та кальцій ацетату;
в) кальцій гідроген карбонату та вугільної кмслоти;
г) барій гідроген карбонат та оцтова кислота.
30.Зв'язок між константою дисоціації слабкого електроліту і ступенем його дисоціації виражається рівнянням:
а) K=α2/C; в)  ;
;
б)  ; г)
; г) 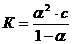
Лабораторна робота № 5
Тема: Йонний добуток води. Водневий показник. Гідроліз солей
|
|
|
Мета: визначення рН розчинів за допомогою індикаторів. Дослідити процес гідролізу солей і встановити фактори, що впливають на гідроліз.
Знати:визначення понять «йонний добуток води», «водневий показник», значення рН в нейтральному, кислому, лужному середовищах, гідроліз солей.
Вміти:розраховувати рН розчинів, записувати рівняння гідролізу солей і визначати реакцію середовища в розчині.
Дата добавления: 2018-02-28; просмотров: 1290; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
